题目内容
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。
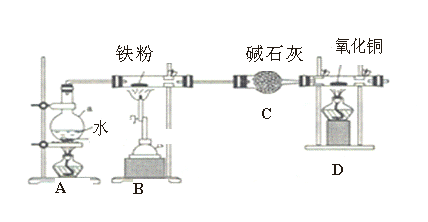
(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
【答案】产生水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 2NA 有黑色变为红色, 硬质玻璃管右端管壁内有水珠 CuO + H2
Fe3O4+4H2 2NA 有黑色变为红色, 硬质玻璃管右端管壁内有水珠 CuO + H2![]() Cu + H2O 先点A处,再点燃B处
Cu + H2O 先点A处,再点燃B处
【解析】
由图可知,A中加热提供水蒸气,在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,C中干燥管干燥氢气,产生氢气还原氧化铜,B中增重的质量其实就是氧的质量。
(1)装置B中铁粉在高温下与水蒸气反应,则A的作用为提供水蒸气,答案为:产生水蒸气;
(2)在B中发生Fe与水蒸气的反应生成四氧化三铁和氢气,反应的方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2,H原子的化合价由+1变为0价,得电子,标准状况下的22.4L为1mol,则转移2mol电子,即2NA;答案为:3Fe+4H2O(g)
Fe3O4+4H2,H原子的化合价由+1变为0价,得电子,标准状况下的22.4L为1mol,则转移2mol电子,即2NA;答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;2NA;
Fe3O4+4H2;2NA;
(3)D中是氢气还原氧化铜得到铜和水即CuO + H2![]() Cu + H2O,观察到的现象为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;CuO + H2
Cu + H2O,观察到的现象为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;CuO + H2![]() Cu + H2O;
Cu + H2O;
(4)氢气还原氧化铜时,先通入氢气排净装置中的空气,以防爆炸,停止反应时,先停止加热氧化铜,再停止通氢气,答案为:先点A处,再点燃B处;

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案