题目内容
9.下列物质的水溶液因水解而呈酸性的是( )| A. | CH3COOH | B. | Na2SO4 | C. | NH4Cl | D. | KNO3 |
分析 电解质溶液因为电解质水解而呈酸性,说明电解质是强酸弱碱盐,据此分析解答.
解答 解:A、CH3COOH属于弱酸,电离显酸性,故A错误;
B、Na2SO4是强酸强碱盐,在溶液中不水解,其溶液呈中性,故B错误;
C、NH4Cl属于强酸弱碱盐,在溶液中铵根离子水解,溶液显酸性,故C正确;
D、KNO3是强酸强碱盐,在溶液中不水解,其溶液呈中性,故D错误;
故选C.
点评 本题考查了盐类水解的原理应用判断,把握盐的组成和物质性质是解题关键,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
19. 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: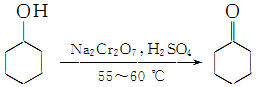 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①仪器A的名称是三颈烧瓶
②仪器A中的反应温度应控制在55~60℃,控制温度的方法是55~60℃水浴加热
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出
(2)环己酮的提纯需要经过以下一系列的操作:
a.在收集到的粗品中加NaCl固体至饱和,静置,分液
b.加入无水MgSO4固体
c.抽滤
d.蒸馏,收集151~156℃馏分,得到精品
①在反应装置图中牛角管上的支管的作用是与大气连通,保持内外压强一致
②加入无水MgSO4固体的作用是去除有机物中水分
③抽滤需要使用的仪器为抽气泵、吸气瓶、布氏漏斗.
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: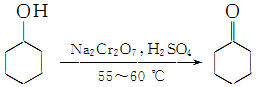 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
①仪器A的名称是三颈烧瓶
②仪器A中的反应温度应控制在55~60℃,控制温度的方法是55~60℃水浴加热
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出
(2)环己酮的提纯需要经过以下一系列的操作:
a.在收集到的粗品中加NaCl固体至饱和,静置,分液
b.加入无水MgSO4固体
c.抽滤
d.蒸馏,收集151~156℃馏分,得到精品
①在反应装置图中牛角管上的支管的作用是与大气连通,保持内外压强一致
②加入无水MgSO4固体的作用是去除有机物中水分
③抽滤需要使用的仪器为抽气泵、吸气瓶、布氏漏斗.
20.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )

| A. | 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 乙装置:橡皮管的作用是能使水顺利流下 | |
| C. | 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. | 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
17.25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件不,单位质量的物质完全燃烧生成稳定氧化物所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1.则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O (l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O (g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-736 kJ•mol-1 |
4.下列属于碱的是( )
| A. | HClO | B. | Na2CO3 | C. | NaOH | D. | CaO |
14.在密闭容器中发生合成氨反应:N2+3H2?2NH3.下列关于该反应的说法正确的是( )
| A. | 增加N2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | N2能100%转化为NH3 |
1.一定温度下,在恒容的密闭容器中发生可逆反应:3X(g)+Y(g)=2Z(g)+W(g)△H=-a kJ•mol-1.下列情况可以说明该反应达到化学平衡状态的是( )
| A. | 2υ(正)(X)=3υ(逆)(Z) | B. | 混合气体的总质量不变 | ||
| C. | 混合气体的密度不变 | D. | △H的数值不变 |
18.如图为氢氧燃料电池的工作原理示意图.下列叙述正确的是( )


| A. | b电极是负极 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 工作时溶液中阴离子移向正极 | |
| D. | 工作时正极区pH升高,负极区pH降低 |
19.下列说法错误的是( )
| A. | 124 g P4含有的P-P键的个数为6NA | |
| B. | 12 g石墨中含有的C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有的C-C键的个数为4NA | |
| D. | 60 g SiO2中含Si-O键的个数为4NA |