题目内容
(1)CO和H2可以合成二甲醚,化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H<0. 如果上述反应方程式的平衡常数K值变大,则该反应 (选填编号).
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(2)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g).
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如下图1所示:
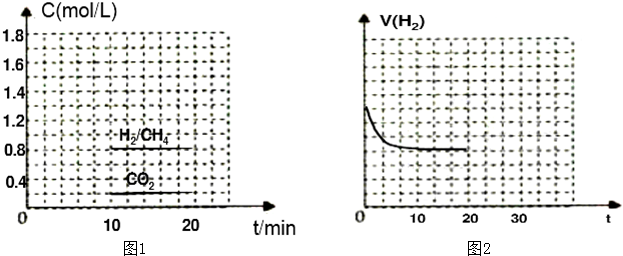
用CH4表示达到平衡时的反应速率 ,该温度下的平衡常数等于 .
②图2表示H2在建立平衡过程中的速率时间图,若现在20min时扩大容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
(3)有人提出设计反应2CO═2C+O2(△H>0)来消除CO的污染,请判断该反应能否自发 (填“能”或“不能”),理由是 .
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(2)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g).
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如下图1所示:

用CH4表示达到平衡时的反应速率
②图2表示H2在建立平衡过程中的速率时间图,若现在20min时扩大容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
(3)有人提出设计反应2CO═2C+O2(△H>0)来消除CO的污染,请判断该反应能否自发
考点:化学平衡的影响因素,焓变和熵变,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)反应方程式的平衡常数K值变大,说明平衡正向进行,平衡常数随温度变化;
(2)①依据化学平衡三段式列式计算,图象中读出平衡浓度,反应速率V=
,结合平衡 常数概念计算,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态;
(3)根据吉布斯自由能的大小判断反应能否进行,△H-T△S<0反应自发进行;
(2)①依据化学平衡三段式列式计算,图象中读出平衡浓度,反应速率V=
| △c |
| △t |
②反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态;
(3)根据吉布斯自由能的大小判断反应能否进行,△H-T△S<0反应自发进行;
解答:
解:(1)化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H<0. 如果上述反应方程式的平衡常数K值变大,说明平衡正向进行,平衡常数随温度变化,改变条件是降低温度,反应速率减小;
A.分析可知反应一定向正反应方向移动,故A正确;
B.在平衡移动时正反应速率先减小后增大,故B错误;
C.分析可知平衡正向进行,故C错误;
D.改变条件是降低温度,平衡正向进行,反应速率减小,在平衡移动时逆反应速率先减小后增大,故D正确;
故答案为:AD;
(2)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率=
=0.08 mol?L-1?min-1;
平衡常数K=
=25;
故答案为:0.08 mol?L-1?min-1;25;
②CO2(g)+4H2(g)?CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图 ;
;
故答案为: ;
;
(3)反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:不可能;△H>0吸热且△S<0 或依据△G判断
A.分析可知反应一定向正反应方向移动,故A正确;
B.在平衡移动时正反应速率先减小后增大,故B错误;
C.分析可知平衡正向进行,故C错误;
D.改变条件是降低温度,平衡正向进行,反应速率减小,在平衡移动时逆反应速率先减小后增大,故D正确;
故答案为:AD;
(2)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率=
| 0.8mol/L |
| 10min |
平衡常数K=
| 0.8×1.62 |
| 0.2×0.84 |
故答案为:0.08 mol?L-1?min-1;25;
②CO2(g)+4H2(g)?CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图
 ;
;故答案为:
 ;
;(3)反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:不可能;△H>0吸热且△S<0 或依据△G判断
点评:本题考查化学反应速率和化学平衡有关知识的综合应用,同时考查学生用数学知识解决化学问题的能力,难度较大,注意平衡常数计算应用,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列溶液的导电能力变化最大(忽略溶液体积变化)的是( )
| A、向100mL含有0.05 molHCI的溶液中加入等物质的量的NaOH固体 |
| B、向100mL含有0.05 molCH3COOH的溶液中通入等物质的量的氨气 |
| C、向100mL含有0.05 molHCI的溶液中加入等物质的量的NaHCO3固体 |
| D、向100mL含有0.05 molCa(OH)2的澄清石灰水中通入标况下224mLCO2气体 |
下列实验设计和结论相符的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热煮沸,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |