题目内容
Na、Mg两者组成的混合物与足量盐酸反应,产生氢气在标准状况下的体积是4.48L,下列推断不正确的是( )
| A、反应过程中无沉淀产生 |
| B、参加反应的HCl共0.4mol |
| C、金属在反应中共失去0.4mol电子 |
| D、钠镁共0.2mol |
考点:钠的化学性质,镁的化学性质
专题:计算题
分析:Na、Mg两者组成的混合物与足量盐酸反应,反应方程式为2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑,根据生成物的溶解性、转移电子相等进行解答.
解答:
解:Na、Mg两者组成的混合物与足量盐酸反应,反应方程式为2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑,
A.氯化镁和氯化钠都属于可溶性盐,所以反应过程中没有沉淀生成,故A正确;
B.氢气的物质的量=
=0.2mol,根据H原子守恒得得n(HCl)=2 n(H2)=0.4mol,故B正确;
C.该反应中转移电子的物质的量=n(H2)×2=0.4mol,故C正确;
D.根据方程式知,无法计算参加反应的钠、镁的总的物质的量,但钠和镁失电子的物质的量为0.4mol,故D错误;
故选D.
A.氯化镁和氯化钠都属于可溶性盐,所以反应过程中没有沉淀生成,故A正确;
B.氢气的物质的量=
| 4.48L |
| 22.4L/mol |
C.该反应中转移电子的物质的量=n(H2)×2=0.4mol,故C正确;
D.根据方程式知,无法计算参加反应的钠、镁的总的物质的量,但钠和镁失电子的物质的量为0.4mol,故D错误;
故选D.
点评:本题考查了钠、镁和稀盐酸之间的反应,注意该题中稀盐酸过量,如果稀盐酸不足量时,则可能产生沉淀,注意审题,题目难度不大.

练习册系列答案
相关题目
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示.已知v(A)、v(B)、v(C)之间有以下关系:2v(A)=3v(B),v(C)=2v(B),则此反应可表示为( )
| A、3A+2B=4C |
| B、2A+3B=6C |
| C、3A+2B=C |
| D、2A+3B=4C |
 室温下,用0.100mol?L-1 NaOH溶液分别滴定20.00mL 0.100mol?L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol?L-1 NaOH溶液分别滴定20.00mL 0.100mol?L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、pH=7时,滴定醋酸消耗的V(NaOH)小于20mL |
| C、V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D、V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列有机化学反应中,属于消去反应的是( )
| A、苯与浓硫酸、浓硝酸混合,温度保持在50℃~60℃ |
| B、溴丙烷与氢氧化钠溶液混合,静置 |
| C、乙醇与浓硫酸共热,温度保持在170℃ |
| D、1-氯丁烷与氢氧化钾水溶液共热 |
有Xn-、Yn+、Z(n+1)-三种粒子,其核外电子层结构相同,则下列分析中不正确的是( )
| A、原子核电荷数:Y>X>Z |
| B、原子半径大小的关系是:Y>Z>X |
| C、离子半径大小的关系是:Z(n+1)->Xn->Yn+ |
| D、氢化物的稳定性:Hn+1Z>HnX |
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
在给定的四种溶液中,加入以下离子,各离子符合条件且能在原溶液中大量共存的是( )
| A、无色透明澄清溶液中:Cr2O72-、I-、Na+、K+ |
| B、pH为0的溶液:Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、已含Fe3+的溶液:K+、SCN-、NO3-、Al3+ |
 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )| A、维生素A的分子式为C18H28O |
| B、一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C、维生素A可使溴水褪色 |
| D、1mol维生素A分子最多可跟5 mol H2发生加成反应 |
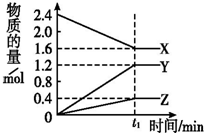 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: