题目内容
13.25℃时,在强碱性溶液中可以大量共存的离子组是( )| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |
分析 强碱性溶液中,含大量的OH-,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,以此解答.
解答 解:A.碱性条件下不能大量共存,且SO32-、MnO4-发生氧化还原反应,故A错误;
B.碱性条件下NH4+、Fe2+、H+不能大量共存,故B错误;
C.碱性条件下HCO3-不能大量共存,生成CO32-,故C错误;
D.碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
3.下列物质中,所含分子数相等的是( )
①4℃时7.2ml水 ②14.7gH2SO4 ③8.4gN2 ④0.3gH2.
①4℃时7.2ml水 ②14.7gH2SO4 ③8.4gN2 ④0.3gH2.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ③④ |
4.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1molH2O2分子中含极性共价键数目为0.3NA |
1.分别向下列物质的水溶液中加入少量过氧化钠固体,不会出现浑浊现象的是( )
| A. | 饱和石灰水 | B. | 氢硫酸 | C. | 碳酸氢钙溶液 | D. | 碳酸氢钠溶液 |
8.下列实验方法导致实验结果偏高的是( )
| A. | 用标准盐酸滴定待测氢氧化钠溶液至终点,读数时视线偏高 | |
| B. | 用含Na2O的NaOH固体配制成的标准溶液,滴定待测盐酸 | |
| C. | 将4.0g NaOH溶解后迅速转移入1L的容量瓶中定容,配制0.1moL/L的NaOH溶液 | |
| D. | 将1mL 98%的浓硫酸加入9mL水中,配制9.8%的稀硫酸 |
18.已知常温常压下在1L的水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+Na2NO2 +H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )
| A. | 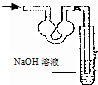 | B. |  | C. |  | D. |  |
5.下列物质制备的方程式不正确的是( )
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20 | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H20═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:Cu+4H++2NO3-═Cu2++2NO2↑+2H20 |
15.反应mA+nB?pC中,若v(A)=a mol•L-1•s-1,则v(C)为 (mol•L-1•s-1)( )
| A. | $\frac{pa}{m}$ | B. | $\frac{m}{pa}$ | C. | $\frac{ma}{p}$ | D. | $\frac{mp}{a}$ |
