题目内容
11.下列离子方程式中不正确的是( )| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 二氧化碳通入澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 氢氧化钡溶液与盐酸混合OH-+H+═H2O |
分析 A.不符合反应客观事实;
B.原子个数不守恒;
C.二氧化碳通入澄清石灰水中反应生成碳酸钙和水;
D.二者反应生成氯化钡和水.
解答 解:A.铁粉与稀硫酸反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.二氧化碳通入澄清石灰水中,离子方程式:CO2+Ca2++2OH-═CaCO3↓+H2O,故C正确;
D.氢氧化钡溶液与盐酸混合,离子方程式:OH-+H+═H2O,故D正确;
故选:AB.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应须遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.实验室配制250mL 0.5mo1•L-1NaCl溶液,不需要用到的仪器是( )
| A. |  玻璃棒 | B. |  酒精灯 | C. |  胶头滴管 | D. |  容量瓶 |
19.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、氨、四氯化碳均为电解质 | |
| D. | 胶体、食用盐、点豆腐的卤水均为混合物 |
6.下列有关混合物的分离方法中,正确的是( )
| A. | 从食盐溶液中获得食盐晶体采用过滤的方法 | |
| B. | 除去自来水中的Cl-可以采用蒸馏的方法 | |
| C. | 将碘晶体中含有的少量沙子除去,采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
16.下列有关化学用语表示正确的是( )
| A. | 过氧化钠的电子式: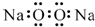 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: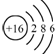 | D. | NH4Cl的电子式: |
20.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见如表:
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(3)温度为T时,该反应的化学平衡常数=0.025.
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(3)温度为T时,该反应的化学平衡常数=0.025.
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
1.下列顺序中,错误的是( )
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸点高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等质量燃烧时的耗氧量:乙烷>乙烯>丙烯 |
 (1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作
(1)教材采用图Ⅰ实验装置测定锌与稀硫酸反应的速率.检查图Ⅰ装置气密性的操作