题目内容
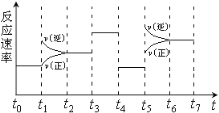
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如下图所示。下列说法正确是( )

A.由图可知三种酸的酸性为:HX<HY<HZ
B.在等物质的量浓度的NaX和HX混合溶液中存在:c(H+)-c(OH-)=c(X-)-c(HX)
C.浓度均为0.1mol/L的NaX、NaY、NaZ的混合溶液中:![]()
D.在pH相等NaX和NaY的溶液中存在:c(HX)+c(X-)=c(HY)+c(Y-)
【答案】C
【解析】
A.由图可知加水稀释,NaX溶液的pH降低得最快,说明NaX的水解程度最小,根据越弱越水解,HX的酸性最强,故三种酸的酸性为:HX>HY>HZ,故A错误;
B.在NaX和HX混合溶液中存在在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(X-),等物质的量浓度的NaX和HX混合溶液中存在物料守恒:2c(Na+)=c(X-)+c(X-),则混合溶液中有2c(H+)-2c(OH-)=c(X-)-c(HX),故B错误;
C.在NaX溶液中存在质子守恒:c(OH-)=c(H+)+c(HX),同理,在NaY中存在:c(OH-)=c(H+)+c(HY),在NaZ中存在:c(OH-)=c(H+)+c(HZ),所以在浓度均为0.1mol/L的NaX、NaY、NaZ的混合溶液中存在:![]() ,根据电离平衡常数的表达式,c(H+)=
,根据电离平衡常数的表达式,c(H+)=![]() ,所以
,所以![]() ,故C正确;
,故C正确;
D.在NaX溶液中存在物料守恒:c(Na+)= c(HX)+c(X-),在NaY溶液中存在物料守恒:c(Na+)= c(HY)+c(Y-),两溶液的pH相等,由于HX和HY的酸性不同,所以两溶液中c(Na+)的不同,所以NaX溶液中的 c(HX)+c(X-)和NaY的溶液中c(HY)+c(Y-)不相等,故D错误;
故选C。

【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________

【题目】对于如下反应,其反应过程的能量变化示意图如图:
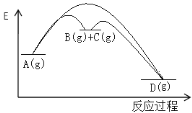
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g) | K1 | △H1 |
反应② | B(g)+C(g) | K2 | △H2 |
反应③ | A(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2
B. ΔH3=ΔH1 +ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变