题目内容
2.下列离子方程式错误的是( )| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液与Ba(OH)2 溶液反应:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
分析 A.二者反应生成硅酸胶体和氯化钠;
B.碘离子还原性强于二价铁离子,氯气少量先氧化碘离子;
C.硫酸氢钠少量,反应生成硫酸钡沉淀、氢氧化钠和水;
D.三价铁离子能够氧化二氧化硫生成硫酸根离子.
解答 解:A.用硅酸钠与盐酸反应制备硅胶,离子方程式:SiO32-+2H+═H2SiO3(胶体),故A正确;
B.FeI2溶液中通入少量Cl2,离子方程式:2I-+Cl2═I2+2Cl-,故B错误;
C.少量NaHSO4 溶液与Ba(OH)2 溶液反应,离子方程式:H++OH-+SO42-+Ba2+═H2O+BaSO4↓,故C正确;
D.FeCl3溶液中通入SO2,溶液黄色褪去,离子方程式:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应的离子方程式书写,明确物质的性质及发生反应的实质是解题关键,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | “地沟油”可以制成肥皂,从而提高资源的利用率 |
14.下列说法正确的是( )
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
13.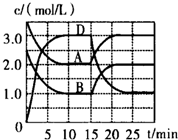 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
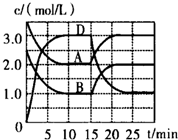 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
14.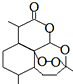 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
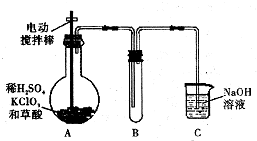 ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.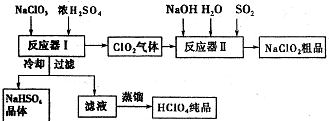
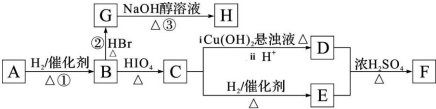
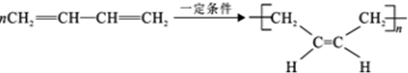 .若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.