题目内容
 “奥运会”严格禁止运动员服用兴奋剂.关于某种兴奋剂(结构简式如图)的以下说法中,正确的是( )
“奥运会”严格禁止运动员服用兴奋剂.关于某种兴奋剂(结构简式如图)的以下说法中,正确的是( )| A、该物质属于芳香烃 |
| B、该物质所有原子都在同一平面上 |
| C、该物质的分子式为C20H25O3 |
| D、1mol该物质最多能与7mol H2加成 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:由有机物结构简式可知有机物含有的元素种类和原子数目,可确定有机物分子式,有机物中含有苯环和碳碳双键,可与氢气发生加成反应,含有酚羟基,可发生取代、氧化和颜色反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答:
解:A.分子中含有O元素,属于烃的衍生物,故A错误;
B.分子中含有饱和烃基,具有甲烷的结构特征,所有的原子不可能在同一个平面上,故B错误;
C.由有机物的结构简式可知该有机物的分子式为C20H24O3,故C错误;
D.分子中含有2个苯环和1个碳碳双键,则1mol该物质最多能与7molH2加成,故D正确.
故选D.
B.分子中含有饱和烃基,具有甲烷的结构特征,所有的原子不可能在同一个平面上,故B错误;
C.由有机物的结构简式可知该有机物的分子式为C20H24O3,故C错误;
D.分子中含有2个苯环和1个碳碳双键,则1mol该物质最多能与7molH2加成,故D正确.
故选D.
点评:本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该题的关键,注意苯环不含碳碳双键,为易错点,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应( )
| A、强酸溶液产生较多的氢气 |
| B、两者产生等量的氢气 |
| C、无法比较两者产生氢气的量 |
| D、弱酸溶液产生较多的氢气 |
已知298K时,Mg(OH)2的溶度积常数为KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A、所加烧碱溶液的pH=13.0 |
| B、所得溶液中c(Mg2+)=5.6×10-10mol/L |
| C、所得溶液中c(H+)=1.0×10-13mol/L |
| D、所得溶液中由水电离产生的c(OH-)=1.0×10-13mol/L |
下列物质的电子式书写正确的是( )
A、NaCl  |
B、H2S  |
C、CCl4  |
D、NH4I  |
下列有关原电池的叙述正确的是( )
| A、把电能转变为化学能,使溶液发生氧化还原反应 |
| B、电子从活泼金属流向不活泼金属,不活泼金属为负极 |
| C、外电路中电子从负极流向正极 |
| D、正极发生氧化反应 |
下列离子或分子组成能大量共存,且满足相应要求的是( )


| A、A | B、B | C、C | D、D |
亮菌甲素适用于治疗急性胆囊炎,其结构简式如图.下列有关叙述正确的是( )
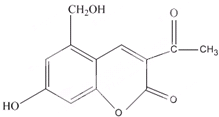

| A、亮菌甲素分子式为C12H11O5 |
| B、1mol亮菌甲素最多能与6mol H2发生加成反应 |
| C、1mol亮菌甲素与NaOH溶液反应,最多消耗3mol NaOH |
| D、亮菌甲素具有弱酸性体现了羟基对苯环的影响 |

