题目内容
13.下列各项中表达正确的是( )| A. | H2O2的电子式: | |
| B. | 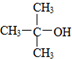 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 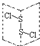 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
分析 A.双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
B.醇的命名选取含有羟基的最长碳链为主链;
C.碳酸氢钠存在两步水解;
D.不同种原子之间形成极性共价键,同种原子之间含有非极性共价键.
解答 解:A.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故A错误;
,故A错误;
B.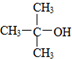 ,为醇类,最长碳链为3,正确命名为2-甲基-2-丙醇,故B错误;
,为醇类,最长碳链为3,正确命名为2-甲基-2-丙醇,故B错误;
C.Na2CO3存在两步水解,NaHCO3只有一步水解,Na2CO3的水解程度大于NaHCO3,所以等物质的量浓度的Na2CO3溶液和NaHCO3溶液,相同浓度的CO32-水解程度大于HCO3-的水解程度,Na2CO3的PH大于NaHCO3,故C错误;
D.S2Cl2的结构类似于H2O2的结构,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,故D正确,故选D.
点评 本题主要考查的是电子式书写、醇类的命名、盐类的水解以及共价键的类型,本题难度不大.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
3.下列有关“化学与生活”的叙述不正确的是( )
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
18.下列说法正确的是( )
| A. | 铁制品锈蚀时主要发生析氢腐蚀 | |
| B. | 施用适量石膏可以降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| C. | 电镀厂未经处理的废水可以直接用来灌溉农田 | |
| D. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 |
5.如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )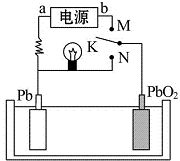

| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
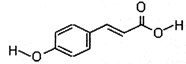
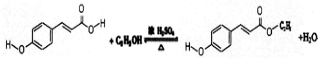 .
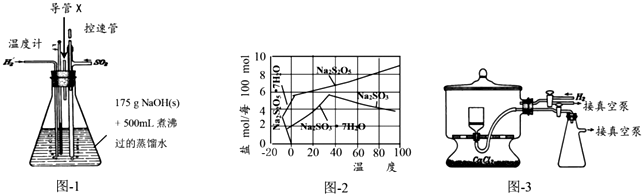
.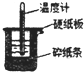 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.