题目内容
(16分)在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)  CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1)该反应的逆反应为 反应(“吸热”或“放热”);
(2)不能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(3) 在850℃时,可逆反应:CO2(g) + H2(g)
 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。

【解析】略

氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式: 。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式: 。
(3)在T1℃时,将5 mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①求该反应的平衡常数K= (数字代入式子即可),上述平衡体系中O2的体积分数为__________。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= 。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大 C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.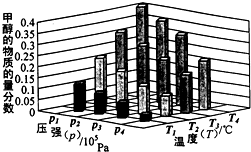 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚. 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。