题目内容
25℃时,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n (1<m<n).下列叙述中不正确的是( )
| A、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
| B、25℃时等浓度的CH3COONa和NaCN溶液,后者pH大 |
| C、HCN溶液和NaOH溶液混合后一定存在:c(H+)-c(OH-)=c (CN-)-c(Na+) |
| D、常温下将pH相同的CH3COOH和HCN溶液稀释相同的倍数时,前者pH变化小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:常温下,等物质的量浓度的醋酸和氢氰酸,氢氰酸的pH大于醋酸,说明醋酸的酸性大于氢氰酸,由于1<m<n,说明二者都是弱酸,
A.等pH的两种酸稀释相同的倍数,弱酸的pH变化小于强酸;
B.等温下,等浓度的醋酸和氢氰酸,酸性越强的酸其pH越小;
C.溶液中存在电荷守恒;
D.酸溶液中由水电离出的氢离子浓度等于溶液中氢氧根离子浓度,根据水的离子积常数计算氢氧根离子浓度即可.
A.等pH的两种酸稀释相同的倍数,弱酸的pH变化小于强酸;
B.等温下,等浓度的醋酸和氢氰酸,酸性越强的酸其pH越小;
C.溶液中存在电荷守恒;
D.酸溶液中由水电离出的氢离子浓度等于溶液中氢氧根离子浓度,根据水的离子积常数计算氢氧根离子浓度即可.
解答:
解:常温下,等物质的量浓度的醋酸和氢氰酸,氢氰酸的pH大于醋酸,说明醋酸的酸性大于氢氰酸,由于1<m<n,说明二者都是弱酸,
A.酸溶液中由水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.1mol?L-1CH3COOH和HCN溶,醋酸溶液中由水电离出的c(H+)=
mol/L=10 m-14mol/L,氢氰酸溶液中由水电离出的c(H+)=
mol/L=10 n-14mol/L,所以前者是后者的10m-n倍,故A正确;
B.等温下,等浓度的CH3COOH和HCN溶液中醋酸的电离程度大于氢氰酸,所以pH后者大,故B正确;
C.根据电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(CN-),所以得c(H+)-c(OH-)=c(CN-)-c(Na+),故C正确;
D.等pH的两种酸稀释相同的倍数,酸性弱的pH变化小于酸性强的,所以pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较大,故D错误;
故选D.
A.酸溶液中由水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.1mol?L-1CH3COOH和HCN溶,醋酸溶液中由水电离出的c(H+)=
| 10-14 |
| 10-m |
| 10-14 |
| 10-n |
B.等温下,等浓度的CH3COOH和HCN溶液中醋酸的电离程度大于氢氰酸,所以pH后者大,故B正确;
C.根据电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(CN-),所以得c(H+)-c(OH-)=c(CN-)-c(Na+),故C正确;
D.等pH的两种酸稀释相同的倍数,酸性弱的pH变化小于酸性强的,所以pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较大,故D错误;
故选D.
点评:本题考查弱电解质的电离,明确酸的浓度和溶液pH的关系是解本题关键,结合电荷守恒来解答,难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
用下列有关实验装置进行相应实验,能达到实验目的是( )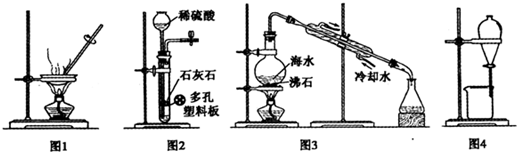

| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
下列浓度关系正确的是( )
| A、0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) |
| B、0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,所得溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) |
| D、pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A、使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- | ||
| B、使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | ||
C、含有0.1 mol?L-1 Fe3+的溶液:Na+、K+、SCN-、NO
| ||
| D、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
二硫化碳(CS2)在标准状况下为液态,能够在氧气中完全燃烧生成CO2和SO2,现用0.228g CS2在672mL O2中完全燃烧,反应后气体混合物在标准状况下的体积是( )
| A、448mL |
| B、224mL |
| C、336mL |
| D、672mL |

 如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
