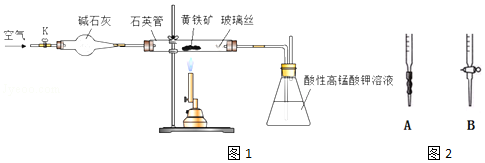
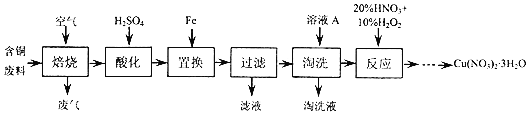
题目内容
6.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2H++2CrO42- (黄色)①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
分析 A、溶液由橙色变为黄色,溶液由黄色变为橙色,说明加入酸碱发生平衡移动;
B、氧化剂的氧化性大于氧化产物分析判断;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子;
D、稀释溶液,平衡状态下离子浓度减小,氢离子浓度减小,溶液中存在离子积,氢氧根离子浓度增大.
解答 解:A、加入氢氧化钠溶液,溶液由橙色变为黄色,说明平衡正向进行,加入硫酸溶液由黄色变为橙色,说明平衡逆向进行,说明加入酸碱发生平衡移动,实验①能证明K2Cr2O7溶液中存在上述平衡,实验②反应中Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O,溶液由橙色变为绿色,不能证明K2Cr2O7溶液中存在上述平衡,故A错误;
B、反应中Cr2O72-+14H++6Fe2+═2Cr3+(绿色)+6Fe3++7H2O,氧化剂的氧化性大于氧化产物,所以实验②能说明氧化性:Cr2O72->Fe3+,故B正确;
C、CrO42-具有氧化剂酸性溶液中氧化亚铁离子,CrO42-和Fe2+在酸性溶液中不可以大量共存,故C错误;
D、稀释K2Cr2O7溶液时,平衡状态下离子浓度减小,氢离子浓度减小,由离子积不变可知,氢氧根离子浓度增大,故D错误;
故选B.
点评 本题考查了盐类水解的分析应用,氧化还原反应的规律分析,平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
16.下列各组离子,在水溶液中能大量共存的是( )
| A. | K+、Ag+、NO3-、Cl- | B. | NH4+、Ba2+、Cl-、CO32- | ||
| C. | H+、Ca2+、CO32-、NO3- | D. | Na+、Al3+、SO42-、NO3- |
1.下列图示与对应的叙述相符的是( )
| A. | 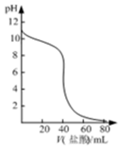 表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. | 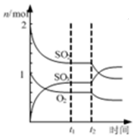 表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 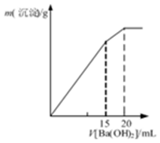 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 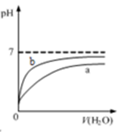 表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
18.在标准状况下,下列物质占体积最大的是( )
| A. | 18g H2O | B. | 6.02×1023个氮分子 | ||
| C. | 44.8L HCl | D. | 6g氢气 |
15.二氧化碳与一氧化碳的混合气体共10.8g,其物质的量为0.3mol.则下列叙述不正确的是( )
| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
16.下列实验操作正确的是( )
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 | |
| D. | 萃取,分液前不需对分液漏斗检漏 |
 回答下列问题:
回答下列问题: