题目内容
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3 杂质。利用明矾石制备氢氧化铝的流程如下:
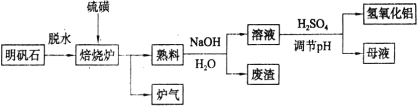
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S=2Al2O3+9SO2,若生成1molAl2O3,则转移的电子数为______。
(2)将标况下1.12L炉气通入100mL0.5mol/LNaOH 溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______。
(3)熟料溶解时反应的离子方程式为_________。
(4)检验废渣中含有Fe2O3所需的试剂是______________。
(5)母液中溶质主要成分的化学式为_______,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是___________。
【答案】3.612×1024 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) Al2O3+2OH-=2AlO2-+H2O 稀盐酸、硫氰化钾 K2SO4、Na2SO4 取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净
【解析】
(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成1molAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性对离子浓度进行排序;
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)由工艺流程可知,废渣的主要成分为Fe2O3,废渣中加入盐酸溶解,再滴加KSCN溶液,若溶液变红色,说明废渣中含有Fe2O3;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调pH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,据此分析判断。
(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×![]() =1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024;
=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024;
(2)标准状况下1.12L二氧化硫的物质的量为 ![]() =0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(4)由工艺流程可知,废渣的主要成分为Fe2O3,取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液变红色,说明废渣中含有Fe2O3,故答案为:稀盐酸、硫氰化钾;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调pH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4;要证明沉淀已洗涤干净即证明最后的洗涤液中不含SO42-,证明沉淀已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;故答案为:K2SO4、Na2SO4;取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为_____。
(2)下列关于反应后的溶液说法不正确的是____(填字母)。
a.实验②反应后溶液中只存在着两个平衡
b.实验②反应后溶液中:c(A-)+c(HA)>0.1mol·L-1
c.实验②反应后溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
d. 实验①反应后的溶液中由水电离出的c(OH-)=10-9mol·L-1;x>0.2mol·L-1
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(3)写出该电池工作时负极的电极反应式____。
(4)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为____。