题目内容
下列各物质溶液中,指定微粒浓度之间的关系不正确的是( )
| A、饱和NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| B、0.1mol/LNaHCO3溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L |
| C、饱和NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) |
| D、0.1mol/LCH3COONa溶液中:c(CH3COO-)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.NaHS中HS-的水解程度大于电离程度,所以溶液呈碱性;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但水解程度较小.
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.NaHS中HS-的水解程度大于电离程度,所以溶液呈碱性;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但水解程度较小.
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(Cl-)+c(OH-),故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故B正确;
C.NaHS中HS-的水解程度大于电离程度,所以溶液呈碱性,所以c(H+)<c(OH-),结合电荷守恒得c(Na+)>c(HS-),水解程度较小,所以溶液中离子浓度大小顺序为c(Na+)>c(HS-)>c(OH-)>c(H+),故C错误;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但水解程度较小,所以c(CH3COO-)>c(OH-),故D正确;
故选C.
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故B正确;
C.NaHS中HS-的水解程度大于电离程度,所以溶液呈碱性,所以c(H+)<c(OH-),结合电荷守恒得c(Na+)>c(HS-),水解程度较小,所以溶液中离子浓度大小顺序为c(Na+)>c(HS-)>c(OH-)>c(H+),故C错误;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但水解程度较小,所以c(CH3COO-)>c(OH-),故D正确;
故选C.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质再结合溶液酸碱性、守恒思想分析解答,注意:盐类水解程度较小,溶液中以盐的电离为主,为易错点.

练习册系列答案
相关题目
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A、该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| B、若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 |
| C、若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D、若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
将4.6g Na和2.7gAl同时加入到足量的水中充分反应,下列说法正确的是( )
| A、所得溶液中阳离子和阴离子的物质的量之比为1:2 |
| B、反应中消耗的水的质量是加入的Al的质量的2倍 |
| C、所得溶液中Na+和Al3+的物质的量之比为2:1 |
| D、反应中放出的气体在标准状况下的体积为2.24L |
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为 .下列说法不正确的是( )
.下列说法不正确的是( )
 .下列说法不正确的是( )
.下列说法不正确的是( )| A、白磷着火点低,在空气中可自燃 |
| B、白磷、红磷互为同素异形体 |
| C、31g白磷中,含P-P键1.5 mol |
| D、已知P4(白磷,s)+3O2(g)═2P2O3(s)△H=-Q kJ?mol-1,则白磷的燃烧热为Q kJ?mol-1 |
下列化学用语正确的是( )
| A、乙烯的分子式:CH2═CH2 |
| B、次氯酸分子的结构式:H-O-Cl |
C、羟基的电子式: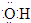 |
| D、以铁作阳极电解时,阳极的电极反应式:Fe-3e-═Fe3+ |
下列物质的溶液中,存在电解质电离平衡的是( )
| A、Ba(OH)2 |
| B、CH3COOH |
| C、CH3COONa |
| D、H2SO4 |