题目内容
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石.已知该尖晶石中混有Fe2O3,取一定量样品5.4g,恰好与一定浓度100mL盐酸反应,盐酸浓度可能是( )
| A、1.9 mol/L |
| B、2.8 mol/L |
| C、4.3 mol/L |
| D、4.9 mol/L |
考点:化学方程式的有关计算
专题:计算题
分析:根据题意,尖晶石与盐酸反应,最终的产物是MgCl2、AlCl3、FelCl3.由于一定量样品5.4g,恰好与100mL一定浓度的盐酸反应,利用极值法进行讨论:
当全部是MgAl2O4时,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,因为恰好溶解,根据n=
计算MgAl2O4的物质的量,进而计算消耗HCl的物质的量,根据c=
计算盐酸的浓度;
假如全部是Fe2O3时,1molFe2O3消耗6molHCl,求出盐酸的物质的量浓度,实际盐酸的物质的量浓度应介于二者之间.
当全部是MgAl2O4时,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,因为恰好溶解,根据n=
| m |
| M |
| n |
| V |
假如全部是Fe2O3时,1molFe2O3消耗6molHCl,求出盐酸的物质的量浓度,实际盐酸的物质的量浓度应介于二者之间.
解答:
解:假设全部是MgAl2O4时,5.4gMgAl2O4的物质的量为
=0.038mol,与盐酸反应最终生成MgCl2和AlCl3,1mol MgAl2O4消耗8molHCl,故消耗HCl的物质的量为8mol×
=0.304mol,故盐酸的浓度为
=3.04mol/L,
假如全部是Fe2O3时,5.4gFe2O3的物质的量为
=0.0338mol,1molFe2O3消耗6molHCl,故消耗盐酸的物质的量为0.0338mol×6=0.203mol,故盐酸的物质的量浓度为
=2.03mol/L,
实际盐酸的物质的量浓度应介于二者之间,故选B.
| 5.4g |
| 142g/mol |
| 0.038mol |
| 1mol |
| 0.304mol |
| 0.1L |
假如全部是Fe2O3时,5.4gFe2O3的物质的量为
| 5.4g |
| 160g/mol |
| 0.203mol |
| 0.1L |
实际盐酸的物质的量浓度应介于二者之间,故选B.
点评:本题考查混合物的有关计算,难度中等,利用混合物列方程进行计算,步骤繁琐而结果易错,导致费时而不易得分,注意利用极值法进行的计算.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
下列液体,一定呈中性的是( )
| A、C(H+)=1×10-7mol?L-1的溶液 |
| B、pH=7的液体 |
| C、C(H+)=C(OH-)=1×10-6mol?L-1的溶液 |
| D、pH=6的水 |
下列变化发生了氧化反应的是( )
| A、Cl2+2e-=2Cl- |
| B、S2--2e-=S |
| C、Ag++e-=Ag |
| D、Cr2O72-+14H++6e-=2Cr3++7H2O |
等物质的量浓度的NaCl、MgCl2两种溶液的体积比为3:2,则两种溶液中Cl-的物质的量浓度之比为( )
| A、1:2 | B、3:4 |
| C、1:1 | D、3:2 |
19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了( )
| A、大量铝土矿 |
| B、电解氧化铝制取铝的方法 |
| C、用金属钠还原氧化铝的方法 |
| D、无水氯化铝与钾制取铝的方法 |
等质量的铝粉,分别与等体积的氢氧化钠溶液和硫酸恰好完全反应,则氢氧化钠溶液和硫酸的物质的量浓度之比是( )
| A、2:3 | B、3:2 |
| C、1:1 | D、1:2 |
下列物质互为同分异构体的是( )
A、
| ||||
| B、氧气和臭氧 | ||||
| C、甲烷和乙烷 | ||||
| D、正丁烷和异丁烷 |
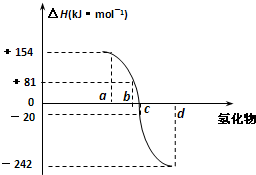 已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )
已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )