题目内容
15.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 58.5g氯化钠固体中,含1NA个阴离子 | |
| D. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
分析 A、铝离子中含10个电子;
B、氯气为双原子分子;
C、求出氯化钠的物质的量,然后根据1mol氯化钠中含1mol氯离子来分析;
D、将氯化钠溶于1L水中后,溶液体积大于1L.
解答 解:A、铝离子中含10个电子,故1mol铝离子中含10mol电子即10NA个,故A错误;
B、氯气为双原子分子,故1mol氯气中含2mol原子即2NA个,故B错误;
C、58.5g氯化钠的物质的量为1mol,而1mol氯化钠中含1mol氯离子,即NA个阴离子,故C正确;
D、将氯化钠溶于1L水中后,溶液体积大于1L,故所得溶液的浓度小于1mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.下列离子反应方程式正确的是( )
| A. | 在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| B. | 向饱和碳酸钠溶液通入过量的二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | 将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
6.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 胶体粒子不能穿过半透膜,但能通过滤纸空隙 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 胶体能够产生丁达尔效应 |
10.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| O2(标况) | 2.24L | 3.36L | 3.36L |
| A. | 15.7g混合物恰好与盐酸完全反应 | |
| B. | 盐酸的物质的量浓度为3.0mol•L-1 | |
| C. | 加入混合物9.2g时盐酸过量 | |
| D. | 根据表中数据能计算出混合物中NaHCO3的质量分数 |
7.将等物质的量的A、B混合于2L密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5min后测得D的浓度为0.5mol•L-1,c(A):c(B)=3:5,用C的浓度变化表示的平均反应速率为0.1mol•L-1•min-1.下列有关结论正确的是( )
| A. | x的值为1 | B. | v(B)=0.2mol•L-1•min-1 | ||
| C. | 反应开始前A的物质的量为3mol | D. | 5min时A的浓度为0.2mol•L-1 |
5.利用右图所示的装置进行下列实验,预测的现象和实际相符的是( )
| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 | 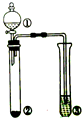 |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
 某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案): A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)