题目内容
18.2007年12月4日浙江省卫生厅公布的最常见的四种疾病中,高血压排在第一位,胆结石排在第二位,可见在全民社会中普及如何预防胆结石显得尤为重要.从化学上讲,非结合胆红素(VCB)分子有羟基,被氧化后(生成羧基)与钙离子结合形成胆红素钙的反应,就是一个生成沉淀的离子反应,从动态平衡的角度分析能预防胆结石的方法是( )| A. | 大量食用纯碱可使钙离子沉淀完全,预防胆结石产生 | |
| B. | 不食用含钙的食品 | |
| C. | 适量服用维生素E、维生素C等抗氧化自由基可预防胆结石 | |
| D. | 手术切除胆囊 |
分析 预防胆结石的生成,就是防止羟基(-OH)被氧化后生成羧基与钙离子结合形成沉淀. 所以适量服用抗氧化自由基的药物 可以预防胆结石的生成.
解答 解:A.纯碱能与钙离子反应,形成沉淀,故A错误;
B.不食用含钙的食品,会导致人体缺钙,故B错误;
C.低维生素E、低维生素C等抗氧化自由基有还原性,能防止羟基(-OH)被氧化后生成羧基,可以防止胆结石,故C正确;
D.胆囊分泌胆汁,胆汁参与脂肪的消化,故D错误.
故选C.
点评 本题考查有机物的结构与性质,题目难度不大,明确根据题干信息明确非结合胆红素含有的官能团及具有的性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.铁元素是重要的金属元素,铁单质及化合物在工业和生活中也有广泛的用途.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
达平衡后,若再加入四种物质,各物质的物质的量如下表:
当重新达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A(用A、B、C表示).
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
6.t℃时,AgCl 的 Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲 线如图所示.下列说法正确的是( )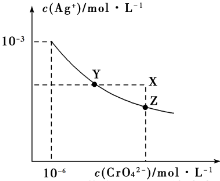

| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
13.有关下列四个常用电化学装置的叙述中正确的是( )
| A. |  如图所示碱性锌锰电池中,负极电极反应为Zn-2e-═Zn2+ | |
| B. | 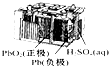 如图所示铅蓄电池放电过程中,硫酸浓度不断增大 | |
| C. |  如图所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 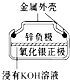 如图所示银锌纽扣电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag |
3.某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
10.下列说法不正确的是( )
| A. | 近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| B. | 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内是为了催熟水果 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 用二氧化碳制全降解塑料,可以缓解温室效应 |
7.用等体积的0.1mol•L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A. | 3:2:3 | B. | 3:1:2 | C. | 2:6:3 | D. | 1:1:1 |
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )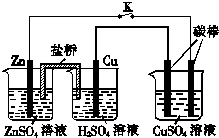

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |