题目内容
6.某同学将铜片加入浓硫酸中,加热后发生反应,探究反应产生的气体产物中是否含有二氧化硫和水蒸气.(1)写出铜跟浓硫酸在加热条件下反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,其中氧化剂是浓硫酸.
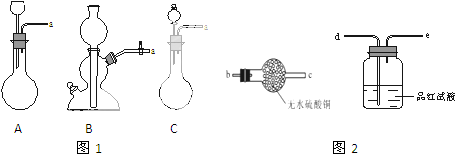
(2)在上述实验中,铜和浓硫酸应放置在图1C(填“A”、“B”或“C”)中进行反应.
(3)将上述反应装置和图2检验装置连接,检验气体产物,连接顺序为(填连接端点的序号):a→b→c→d.
(4)酸雨是指pH小于5.6的降水.由二氧化硫形成的酸雨中含一种强酸,该酸是H2SO4,这种酸雨形成过程中的氧化剂是O2(填化学式).
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水;该反应中浓硫酸被还原成二氧化硫,氧化剂为浓硫酸;
(2)根据反应方程式可知,该反应需要加热,需要用分液漏斗控制浓硫酸的流出情况,据此选出合理装置;
(3)反应产物中有水和二氧化硫,需要先检验水,再检验二氧化硫,据此连接装置;
(4)由于雨水中溶有二氧化碳,所以正常与水的pH为5.6;二氧化硫雨水反应生成亚硫酸,亚硫酸容易被空气中的氧气氧化成硫酸;所以酸雨形成过程中的氧化剂为氧气.
解答 解:(1)浓硫酸具有强的氧化性,能和金属铜在加热条件下反应,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中铜化合价升高被氧化,为还原剂,硫酸被还原成二氧化硫,化合价降低被还原,作氧化剂,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;浓硫酸;
(2)A装置无法可知浓硫酸的用量,应该使用分液漏斗;B装置不能加热,而浓硫酸与铜的反应需要加热才能进行;只有装置C满足反应条件,浓硫酸盛放在分液漏斗中,铜放入圆底烧瓶中,
故答案为:C;
(3)反应发生装置为C,然后先用无水硫酸铜检验水,再用品红溶液检验二氧化硫气体,所以装置连接顺序为:a→b→c→d,
故答案为:b;c;d;
(4)雨水中溶有二氧化碳,二氧化碳与水反应生成的碳酸为弱酸,则正常雨水的pH为5.6;二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,容易被空气中的O2氧化成H2SO4,所以酸雨形成过程中的氧化剂为O2,
故答案为:5.6;H2SO4;O2.
点评 本题考查了浓硫酸的性质,题目难度中等,明确铜与浓硫酸的反应原理为解答关键,注意掌握浓硫酸的性质、酸雨的形成过程及化学实验装置的连接方法,试题培养了学生的分析能力及化学实验能力.

 发散思维新课堂系列答案
发散思维新课堂系列答案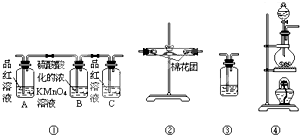 已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.