题目内容
粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质.食用精盐是用粗盐提纯而得到的.回答下列问题:
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①加热搅拌;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③固定铁圈位置;④放置酒精灯; ⑤停止加热.其正确的操作顺序为 (填序号).
(2)检验溶液中有无SO42-离子的操作为 .
(3)在粗盐经过溶解→过滤→除SO42-离子后,再滴加NaOH溶液和饱和Na2CO3溶液,直至不再产生沉淀为止,这步操作的目的是 .
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:溶解时: ;
过滤时: ;
蒸发时: .
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①加热搅拌;②放上蒸发皿(蒸发皿中盛有NaCl溶液);③固定铁圈位置;④放置酒精灯; ⑤停止加热.其正确的操作顺序为
(2)检验溶液中有无SO42-离子的操作为
(3)在粗盐经过溶解→过滤→除SO42-离子后,再滴加NaOH溶液和饱和Na2CO3溶液,直至不再产生沉淀为止,这步操作的目的是
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:溶解时:
过滤时:
蒸发时:
考点:粗盐提纯
专题:实验题
分析:(1)组装仪器的一般顺序是采用先下后上,先左后右的原则,据此对各操作进行排序;
(2)检验SO42-要排除碳酸根的干扰,利用硫酸根离子可以和钡离子反应生成硫酸钡沉淀来回答;
(3)氢氧化钠与镁离子、碳酸根离子与钙离子、钡离子生成沉淀,据此进行解答;
(4)玻璃棒具有搅拌和引流的作用,根据具体操作方法判断玻璃棒的作用.
(2)检验SO42-要排除碳酸根的干扰,利用硫酸根离子可以和钡离子反应生成硫酸钡沉淀来回答;
(3)氢氧化钠与镁离子、碳酸根离子与钙离子、钡离子生成沉淀,据此进行解答;
(4)玻璃棒具有搅拌和引流的作用,根据具体操作方法判断玻璃棒的作用.
解答:
解:(1)组装仪器时要从下向上组装,酒精灯在铁圈和蒸发皿的下方,所以要先放酒精灯;然后再固定铁圈,放置蒸发皿;然后再点燃酒精灯加热,并搅拌,当有较多晶体析出时,停止加热,借余热蒸干,
故答案为:④③②①⑤;
(2)检验SO42-要排除碳酸根的干扰,所以要加入盐酸,不产生气泡,再利用硫酸根离子可以和钡离子反应生成硫酸钡沉淀,加入氯化钡溶液,如果产生白色沉淀,证明有硫酸根离子,
故答案为:在试管中去少量原溶液,先滴加盐酸后,无明显变化,再滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,溶液中含有SO42-;
(3)在粗盐经过溶解→过滤→除SO42-离子后,再滴加NaOH溶液和饱和Na2CO3溶液,直至不再产生沉淀为止,目的是除去溶液中原有的Ca2+及Mg2+和过量的Ba2+,
故答案为:除去溶液中原有的Ca2+及Mg2+和过量的Ba2+;
(4)实验室里将粗盐制成精盐的过程中,溶解操作中,玻璃棒的作用是搅拌,加速溶解;过滤时可以引流,防止外洒;蒸发时搅拌,防止因局部过热液滴或晶体飞溅,
故答案为:搅拌,加速溶解;引流;搅拌,防止因局部过热液滴或晶体飞溅.
故答案为:④③②①⑤;
(2)检验SO42-要排除碳酸根的干扰,所以要加入盐酸,不产生气泡,再利用硫酸根离子可以和钡离子反应生成硫酸钡沉淀,加入氯化钡溶液,如果产生白色沉淀,证明有硫酸根离子,
故答案为:在试管中去少量原溶液,先滴加盐酸后,无明显变化,再滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,溶液中含有SO42-;
(3)在粗盐经过溶解→过滤→除SO42-离子后,再滴加NaOH溶液和饱和Na2CO3溶液,直至不再产生沉淀为止,目的是除去溶液中原有的Ca2+及Mg2+和过量的Ba2+,
故答案为:除去溶液中原有的Ca2+及Mg2+和过量的Ba2+;
(4)实验室里将粗盐制成精盐的过程中,溶解操作中,玻璃棒的作用是搅拌,加速溶解;过滤时可以引流,防止外洒;蒸发时搅拌,防止因局部过热液滴或晶体飞溅,
故答案为:搅拌,加速溶解;引流;搅拌,防止因局部过热液滴或晶体飞溅.
点评:本题主要考查了粗盐的提纯,题目难度不大,明确除杂的方法和原则为解答本题的关键,注意除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,且为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述不正确的是( )
A、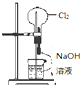 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、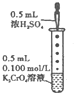 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、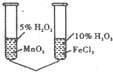 由该实验可以验证催化剂的催化效果 |
D、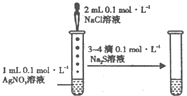 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
下列说法错误的是( )
| A、FeS不溶于水,但能溶于稀硫酸中 |
| B、CaCO3难溶于稀硫酸,也难溶于醋酸中 |
| C、洗涤沉淀时用水洗涤造成的BaSO4损失量大于用稀硫酸洗涤的损失量 |
| D、某离子被沉淀完全,但该离子在溶液中的浓度不为0 |
2012年,大量媒体报道了“毒胶囊”事件,不法厂商用工业明胶代替食用明胶制备药用胶囊,导致重金属铬的含量超标,严重危害人体健康.工业明胶是动物皮经铬鞣制后得到的.下列说法不正确的是( )
| A、皮革鞣制过程中使用的K2Cr2O7会使蛋白质盐析 |
| B、明胶的主要成分是蛋白质 |
| C、不可以将工业明胶掺入奶粉以提高奶粉中蛋白质的含量 |
| D、食用明胶(如果胶、黄原胶等)可以作食品添加剂 |
 某同学受2Mg+CO2
某同学受2Mg+CO2 实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题: