题目内容
将10g铁置于40mL某浓度的硝酸中,再微热充分反应后,共收集到1792mL混合气体,溶液里还残留4.4g固体(标准状况).求:
(1)反应被还原的硝酸与未被还原的硝酸的物质的量
(2)原硝酸溶液的物质的量浓度
(3)混合气体的组成成分及其体积比.
(1)反应被还原的硝酸与未被还原的硝酸的物质的量
(2)原硝酸溶液的物质的量浓度
(3)混合气体的组成成分及其体积比.
考点:化学方程式的有关计算
专题:计算题
分析:反应中残留固体为Fe,说明硝酸完全反应,反应生成硝酸亚铁,Fe与浓硝酸反应得到二氧化氮,随反应进行浓硝酸变稀,与稀硝酸反应得到NO,故混合气体为NO、NO2,
(1)被还原的硝酸生成NO、NO2,未被还原的硝酸生成硝酸亚铁,根据参加反应的Fe计算硝酸亚铁物质的量,根据N元素守恒计算;
(2)根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO、NO2),再根据c=
计算;
(3)令混合气体在NO、NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算解答.
(1)被还原的硝酸生成NO、NO2,未被还原的硝酸生成硝酸亚铁,根据参加反应的Fe计算硝酸亚铁物质的量,根据N元素守恒计算;
(2)根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO、NO2),再根据c=
| n |
| V |
(3)令混合气体在NO、NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算解答.
解答:
解:反应中残留固体为Fe,说明硝酸完全反应,反应生成硝酸亚铁,Fe与浓硝酸反应得到二氧化氮,随反应进行浓硝酸变稀,与稀硝酸反应得到NO,故混合气体为NO、NO2,
(1)被还原的硝酸生成NO、NO2,根据N元素守恒,n被还原(HNO3)=n(NO、NO2)=
=0.08mol,参加反应Fe的物质的量=
=0.1mol,未被还原的硝酸生成硝酸亚铁,故n未被还原(HNO3)=2n[Fe(NO3)2]=0.1mol×2=0.2mol,
答:反应被还原的硝酸的物质的量为0.08mol,未被还原的硝酸的物质的量为0.2mol;
(2)根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO、NO2)=0.2mol+0.08mol=0.28mol,故原硝酸溶液的物质的量浓度=
=7mol/L,
答:原硝酸溶液的物质的量浓度为7mol/L;
(3)令混合气体在NO、NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程:
解得x=0.06、y=0.02
故NO、NO2的体积之比=0.06mol:0.02mol=3:1,
答:混合气体的成分为NO、NO2,二者体积之比为3:1.
(1)被还原的硝酸生成NO、NO2,根据N元素守恒,n被还原(HNO3)=n(NO、NO2)=
| 1.792L |
| 22.4L/mol |
| 10g-4.4g |
| 56g/mol |
答:反应被还原的硝酸的物质的量为0.08mol,未被还原的硝酸的物质的量为0.2mol;
(2)根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO、NO2)=0.2mol+0.08mol=0.28mol,故原硝酸溶液的物质的量浓度=
| 0.28mol |
| 0.04L |
答:原硝酸溶液的物质的量浓度为7mol/L;
(3)令混合气体在NO、NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程:
|
解得x=0.06、y=0.02
故NO、NO2的体积之比=0.06mol:0.02mol=3:1,
答:混合气体的成分为NO、NO2,二者体积之比为3:1.
点评:本题考查化学方程式计算,难度不大,明确发生的反应是关键,注意利用守恒思想进行解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有机结构理论中有一个重要的观点:有机化合物分子中,原子(团)之间相互影响,从而导致有机化合物化学性质不同.以下事实中,不能够说明此观点的是( )
| A、乙烯能使酸性KMnO4溶液退色,而甲烷不能 |
| B、甲苯能使酸性KMnO4溶液退色,而甲烷不能 |
| C、乙酸能与NaHCO3反应放出气体,而乙醇不能 |
| D、苯硝化反应一般生成硝基苯,而甲苯硝化反应生成三硝基甲苯 |
 某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?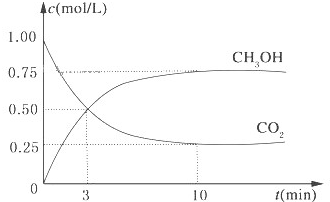 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.


 金属铜广泛地应用于电气、机械制造、国防等领域.
金属铜广泛地应用于电气、机械制造、国防等领域.