题目内容
下列离子方程式书写正确的是( )
| A、Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |||
| B、NaHCO3溶液的电离:HCO3-+H2O?CO32-+H3O+ | |||
| C、NH4Cl溶液的水解:NH4++H2O?NH3?H2O+H+ | |||
D、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
|
考点:离子方程式的书写,热化学方程式
专题:
分析:A.硫离子的水解分步进行,其水解方程式需要分步写,主要以第一步为主;
B.碳酸氢钠为强电解质,溶液中碳酸氢钠完全电离出钠离子和碳酸氢根离子;
C.铵根离子水解生成一水合氨和氢离子,溶液显示酸性;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,该反应是可逆反应,参加反应的氮气物质的量小于0.5mol.
B.碳酸氢钠为强电解质,溶液中碳酸氢钠完全电离出钠离子和碳酸氢根离子;
C.铵根离子水解生成一水合氨和氢离子,溶液显示酸性;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,该反应是可逆反应,参加反应的氮气物质的量小于0.5mol.
解答:
解:A.Na2S溶液溶液中,硫离子的水解分步进行,水解以第一步为主,其正确的离子方程式为:S2-+H2O?HS-+OH-,故A错误;
B.NaHCO3为强电解质,溶液中完全电离,其正确的电离方程式为:NaHCO3=HCO3-+Na+,故B错误;
C.NH4Cl为强酸弱碱盐,铵根离子在溶液中部分水解生成一水合氨和氢离子,铵根离子水解的离子方程式为:NH4++H2O?NH3?H2O+H+,故C正确;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,反应为可逆反应,参加反应的氮气物质的物质的量小于0.5mol,所以1mol氮气反应,放出的热量大于38.6kJ,故D错误;
故选C.
B.NaHCO3为强电解质,溶液中完全电离,其正确的电离方程式为:NaHCO3=HCO3-+Na+,故B错误;
C.NH4Cl为强酸弱碱盐,铵根离子在溶液中部分水解生成一水合氨和氢离子,铵根离子水解的离子方程式为:NH4++H2O?NH3?H2O+H+,故C正确;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,反应为可逆反应,参加反应的氮气物质的物质的量小于0.5mol,所以1mol氮气反应,放出的热量大于38.6kJ,故D错误;
故选C.
点评:本题考查了离子方程式、热化学方程式的书写判断,题目难度中等,涉及电离方程式、水解方程式、热化学方程式的书写,注意掌握强弱电解质的概念及可逆反应特点.

练习册系列答案
相关题目
下列有关pH或c(H+)变化的判断中,正确的是( )
| A、其他条件不变,温度的升高,纯水的pH不变 |
| B、其他条件不变,加水稀释后,碳酸钠溶液的c(H+)减小 |
| C、其他条件不变,温度的升高,碳酸溶液的c(H+)基本不变 |
| D、其他条件不变,常温pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
下列化学及实验用语书写正确的是( )
| A、崔化剂 | B、椎形瓶 |
| C、蒸发皿 | D、粹取 |
 有机物A可发生如下转化:
有机物A可发生如下转化: 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示: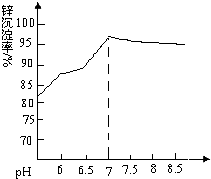 纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu
纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示: