题目内容
在一定温度下,一定体积的容器中,可逆反应:A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A、A、B、C的浓度相等 |
| B、容器中压强不再变化 |
| C、单位时间消耗nmol A,同时生成2n mol C |
| D、A、B、C的分子数比为1:3:2 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:可逆反应A(g)+3B(g)?2C(g)达到平衡状态时,正逆反应速率一定相等,平衡时各种物质的物质的量、浓度、百分含量等不再发生变化,据此进行判断.
解答:
解:A.当A、B、C的浓度相等时,该反应可能达到平衡状态,也可能未达到平衡状态,与反应物的初始浓度和转化率有关,无法判断是否达到平衡状态,故A错误;
B.如果反应前后气体的化学计量数之和不相等,当容器中压强不变时,则说明各组分浓度不再变化,必定达到平衡状态,故B正确;
C.无论该反应是否达到平衡状态,单位时间消耗n mol A,同时生成2n molC,无法判断是否达到平衡状态,故C错误;
D.反应达到平衡时,A、B、C的分子数之比可能为1:3:2,也可能不是1:3:2,这与该反应的初始分子数及转化率有关,无法判断是否达到平衡状态,故D错误;
故选B.
B.如果反应前后气体的化学计量数之和不相等,当容器中压强不变时,则说明各组分浓度不再变化,必定达到平衡状态,故B正确;
C.无论该反应是否达到平衡状态,单位时间消耗n mol A,同时生成2n molC,无法判断是否达到平衡状态,故C错误;
D.反应达到平衡时,A、B、C的分子数之比可能为1:3:2,也可能不是1:3:2,这与该反应的初始分子数及转化率有关,无法判断是否达到平衡状态,故D错误;
故选B.
点评:本题考查化学平衡状态的判断,题目难度中等,注意化学平衡状态的根本标志是:①v(正) =v(逆),②各组分百分含量不变;在解题时要牢牢抓住这两个根本标志,并明确气体的密度、压强、平均相对分子质量的变化与根本标志的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
0.1mol/L NH4Cl溶液中,如果要使c (NH4+)接近于0.1mol/L,可采取的措施是( )
| A、加入少量氢氧化钠 |
| B、加入少量盐酸 |
| C、加入少量水 |
| D、加热 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛也能被氧化为乙酸 |
| C、乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应 |
| D、淀粉和纤维素互为同分异构体 |
下列说法错误的是( )
| A、废纸、金属、玻璃、塑料属于可回收利用垃圾 |
| B、空气质量报告中涉及的污染物主要是SO2、NO2和可吸入颗粒物 |
| C、应用离子交换树脂既可以软化硬水,又可杀菌消毒 |
| D、装饰材料是居室空气污染的源头之一 |
250℃,下列各组离子能大量共存的是( )
| A、pH=1溶液中:K+、Mg2+、AlO2-、S2O32- | ||
| B、Na2S溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、含Fe2+溶液中:Na+、ClO-、CH3COO-、HCO3- |
用NA表示阿伏加德罗常数的值.则下列说法正确的是( )
| A、标准状况下,22.4L己烷中共价键数目为19NA | ||
B、1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO
| ||
C、1cm3铁所含的铁原子数是
| ||
| D、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
在水溶液中能大量共存的一组离子是( )
| A、H+、SO42-、Na+、SiO32- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、K+、SO42-、Mg2+、NO3- |
| D、H+、I-、Cl-、NO3- |

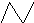 ,有机物A的键线式结构为
,有机物A的键线式结构为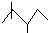 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A.则: