题目内容
18.用固体氢氧化钠配制一定物质的量浓度溶液时,下列操作能导致溶液浓度偏高的是( )| A. | 在烧杯中溶解时,有少量液体溅出 | B. | 样品中混有碳酸钠固体 | ||
| C. | 容量瓶使用前未经干燥 | D. | 定容时俯视容量瓶刻度线 |
分析 结合c=$\frac{n}{V}$及不当操作可知,n偏大或V偏小,则会使所配制的溶液浓度偏大,以此来解答.
解答 解:A.在烧杯中溶解时,有少量液体溅出,n偏小,则浓度偏小,故A不选;
B.样品中混有碳酸钠固体,则NaOH固体质量偏小,n偏小,则浓度偏小,故B不选;
C.容量瓶使用前未经干燥,对实验无影响,故C不选;
D.定容时俯视容量瓶刻度线,V偏小,则浓度偏大,故D选;
故选D.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,把握浓度公式、实验操作为解答的关键,侧重分析与实验能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
8.食品香精菠萝酯的生产路线(反应条件略去)如下:
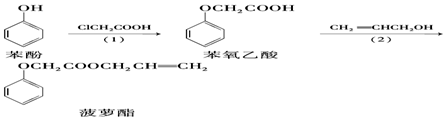
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯氧乙酸分子中含有醚键、羧基两种官能团 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
9.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
其中正确的操作顺序是( )
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
其中正确的操作顺序是( )
| A. | ②⑤④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ⑤②①④③ |
6.将1mol Na2SO4溶于水配成500mL溶液,则Na2SO4溶液的物质的量的浓度为( )
| A. | 2mol/L | B. | 1 mol/L | C. | 0.01 mol/L | D. | 0.22 mol/L |
13.取2.8g某元素的单质X在一定条件下与氧气充分作用,得到6g化合物XO2,该元素在周期表中处于( )
| A. | 第3周期 | B. | 第2周期 | C. | 第ⅣA族 | D. | 第ⅤA族 |
3.下列离子方程式中正确的是( )
| A. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 实验室用大理石和稀盐酸制取CO2:2H++CaCO3═Ca2++CO2↑+H2O |
10. 如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
 如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )
如图所示的装置,C、D、E、F、X、Y都惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.则以下说不正确的是( )| A. | 电源B极是负极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1~2~2~2√ | |
| C. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
2.下列关于钠的说法不正确的是( )
| A. | 金属钠与O2反应,条件不同,产物不同 | |
| B. | 少量钠可保存在煤油中 | |
| C. | 金属钠质软,可以用小刀切割 | |
| D. | 由于钠很活泼,所以它能从水溶液中置换出金属活动性顺序表中排在钠后面的金属 |