题目内容
2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献.可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应.

(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有
a.C2H4是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶
①V2+基态时核外电子排布式为 .
②熔融空气电池钒硼晶体晶胞结构如图1所示,该晶胞中含有钒原子数目为 .
(3)烟酰胺结构式如图2所示,可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有 ,1mol该分子中含σ键数目为 .
(4)配离子[Cu(NH3)4]2+中N原子是配位原子.已知NF3与NH3的空间构型相同,但NF3中N不易与Cu2+形成配离子,其原因是 .

(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有
a.C2H4是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶
①V2+基态时核外电子排布式为
②熔融空气电池钒硼晶体晶胞结构如图1所示,该晶胞中含有钒原子数目为
(3)烟酰胺结构式如图2所示,可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有
(4)配离子[Cu(NH3)4]2+中N原子是配位原子.已知NF3与NH3的空间构型相同,但NF3中N不易与Cu2+形成配离子,其原因是
考点:晶胞的计算,判断简单分子或离子的构型,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)a.正负电荷重心重合的分子为非极性分子;
b.根据价层电子对互斥理论确定其空间构型;
c.NO+和氮气分子属于等电子体,等电子体结构相似;
d.NH3中氢键导致氨气熔沸点较高;
(2)①V2+基态时核外电子数是21,V是23号元素,V原子失去最外层电子生成V2+,根据构造原理书写V2+核外电子排布式;
②利用均摊法计算该晶胞中含有钒原子数目;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,据此判断N原子杂化方式,l个该分子中含σ键数目为15,据此计算lmol该分子中含σ键数目;
(4)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断.
b.根据价层电子对互斥理论确定其空间构型;
c.NO+和氮气分子属于等电子体,等电子体结构相似;
d.NH3中氢键导致氨气熔沸点较高;
(2)①V2+基态时核外电子数是21,V是23号元素,V原子失去最外层电子生成V2+,根据构造原理书写V2+核外电子排布式;
②利用均摊法计算该晶胞中含有钒原子数目;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,据此判断N原子杂化方式,l个该分子中含σ键数目为15,据此计算lmol该分子中含σ键数目;
(4)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断.
解答:
解:(1)a.正负电荷重心重合的分子为非极性分子,C2H4结构对称且正负电荷重心重合,所以是非极性分子,故正确;
b.碳负离子CH3-价层电子对个数=3+
(4+1-3×1)=4且含有一个孤电子对,所以为三角锥形,故正确;
c.NO+和氮气分子属于等电子体,等电子体结构相似,所以NO+电子式为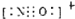 ,故正确;
,故正确;
d.NH3中含有氢键、N2中不含氢键,NH3中氢键导致氨气熔沸点较高,故错误;
故选abc;
(2)①V2+基态时核外电子数是21,V是23号元素,V原子失去最外层电子生成V2+,根据构造原理知V2+核外电子排布式为1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
②根据图片知,该晶胞中含有钒原子数目=2×
+8×
+8×
=4,
故答案为:4;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,所以环上N原子采用sp2杂化,氨基上N原子采用杂化sp3,l个该分子中含σ键数目为15,所以lmol该分子中含σ键数目为15mol或15×6.02×1023,
故答案为:sp2、sp3;15mol或15×6.02×1023;
(4)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,
故答案为:N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键.
b.碳负离子CH3-价层电子对个数=3+
| 1 |
| 2 |
c.NO+和氮气分子属于等电子体,等电子体结构相似,所以NO+电子式为
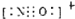 ,故正确;
,故正确;d.NH3中含有氢键、N2中不含氢键,NH3中氢键导致氨气熔沸点较高,故错误;
故选abc;
(2)①V2+基态时核外电子数是21,V是23号元素,V原子失去最外层电子生成V2+,根据构造原理知V2+核外电子排布式为1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
②根据图片知,该晶胞中含有钒原子数目=2×
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |
故答案为:4;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,所以环上N原子采用sp2杂化,氨基上N原子采用杂化sp3,l个该分子中含σ键数目为15,所以lmol该分子中含σ键数目为15mol或15×6.02×1023,
故答案为:sp2、sp3;15mol或15×6.02×1023;
(4)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,
故答案为:N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键.
点评:本题考查了物质结构和性质,涉及原子杂化方式的判断、核外电子排布式的书写、配位键、晶胞的计算等知识点,利用价层电子对互斥理论、构造原理、配位键概念、均摊法等知识点来分析解答,这些知识点都是考试高频点,熟练掌握这些知识解答问题.

练习册系列答案
相关题目
 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列说法不正确的是( )
| A、在熔融电解质中,O2-向负极定向移动 |
| B、电池的总反应是:2C4H10+13O2═8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为:O2+4e-═2O2- |
| D、通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
已知NaOH+H2O2=H2O+NaHO2.现用H2O2-Al燃料电池电解尿素[CO(NH2)2]和KOH的混合溶液制备氢气 (c、d均为惰性电极,电解池中隔膜仅阻止气体通过).下来说法不正确的是( )

| A、燃料电池总反应为:3HO2-+2Al=OH-+2AlO2-+H2O |
| B、电极b是正极,且反应后该电极区pH增大 |
| C、每消耗27g Al,理论上产生11.2L(标准状况下)氮气 |
| D、反应时,电子的流向为:a→b→c→d. |
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、CH4+2O2═CO2+2H2O | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2KClO3
| ||||
| D、CaCO3+2HCl=CaCl2+H2O+CO2↑ |

