题目内容
将盛有等物质的量浓度,等体积的稀硫酸的两个烧杯分别置于托盘天平上,调节天平使之平衡,然后在两个烧杯中分别加入a g的铁粉和a g的锌粉.试通过计算讨论天平的平衡情况.
答案:
解析:
解析:
| 解析:反应后天平要平衡,必须符合产生的H2质量相等,因投入的金属的质量是相等的.等质量的Fe、Zn能放出电子物质的量与等摩尔H+所接受电子的关系,可假设H2SO4为一变量来加以讨论.设H2SO4的物质的量为m.
a g Fe能放出电子: a g Zn能放出电子: 用数轴表示上述两点:
这时H+的物质的量2m与生成H2的情况如下: 条件 产生H2 天平平衡情况 (1)当0<m≤ (2)当 (3)当m> 小结:解衡量问题的计算题,除注意熟练掌握差量法,全面、细致讨论外,有时借助数学工具会给我们带来很大方便.既直观,又准确且能防止漏解.
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
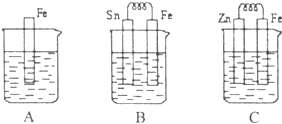 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.