题目内容
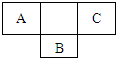 (2013?浙江模拟)三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为15.据此填空:
(2013?浙江模拟)三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为15.据此填空:①写出B的元素符号:B
P
P
,C的氢化物的结构式H-O-H
H-O-H
.②写出A元素的最高价氧化物的结构式
O=C=O
O=C=O
,电子式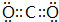
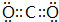
分析:由三种短周期A、B、C在元素周期表中的位置可知,A、C处于第二周期、B处于第三周期,设A原子的最外层电子数为x,根据A、B、C三元素在元素周期表中的位置,则B原子最外层电子数为x+1,C的原子最外层电子数为x+2,又A、B、C 三种元素的原子最外层电子数之和为15,则有x+x+1+x+2=15,解得x=4,所以A为C元素,B为P元素,C为O元素,据此解答.
解答:解:由三种短周期A、B、C在元素周期表中的位置可知,A、C处于第二周期、B处于第三周期,设A原子的最外层电子数为x,根据A、B、C三元素在元素周期表中的位置,则B原子最外层电子数为x+1,C的原子最外层电子数为x+2,又A、B、C 三种元素的原子最外层电子数之和为15,则有x+x+1+x+2=15,解得x=4,所以A为C元素,B为P元素,C为O元素,
①由上述分析可知,B的元素符号为:P;C的氢化物为H2O,分子中H原子与氧原子之间形成1对共用电子对,其结构式H-O-H,
故答案为:P;H-O-H;
②A元素的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,其结构式为O=C=O,电子式为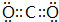 ,
,
故答案为:O=C=O;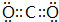 .
.
①由上述分析可知,B的元素符号为:P;C的氢化物为H2O,分子中H原子与氧原子之间形成1对共用电子对,其结构式H-O-H,
故答案为:P;H-O-H;
②A元素的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,其结构式为O=C=O,电子式为
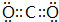 ,
,故答案为:O=C=O;
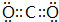 .
.点评:本题考查位置结构性质关系应用、常用化学应用,题目难度不大,推断元素是解题关键,本题中侧重于化学用语的考查.

练习册系列答案
相关题目

 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将 CH3OCH3+H2O
CH3OCH3+H2O CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为