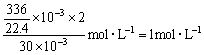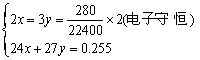题目内容
在标况下进行甲、乙、丙三组实验,各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:实验序号 甲 乙 丙
合金质量/g 0.255 0.385 0.459
生成气体/mL 280 336 336
试回答:
(1)甲组实验中盐酸_________,乙组实验中盐酸_________(填“过量”或“适量”或“不足量”)。
(2)要推导出盐酸的物质的量浓度,所提供的数据中作计算依据的是_________,计算出盐酸的物质的量浓度为_________mol×L-1。
(3)要求出合金中镁、铝的物质的量之比,可作计算依据的数据是_________,镁、铝的物质的量之比为__________。
(4)在丙组实验之后,向容器中加入一定体积1mol×L-1的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子刚好完全沉淀,则溶液中偏铝酸钠的物质的量为__________mol,氯化钠的物质的量为_________mol,所加苛性钠溶液的体积为__________mL。
解析:
| 精析 本题设问新颖,形式灵活,此题若用守恒法分析解答,则可使问题简捷明了。
(1)根据表中数据,加入盐酸相同,产生H2的量不一,可立即作出判断:甲组实验中盐酸过量,乙组实验中盐酸不足量。 (2)要推算盐酸的浓度,所提供的数据中作计算依据的应是30mL、336mL。具体计算时直接利用“H”守恒c(HCl) (3)要求合金中镁、铝的物质的量之比,可作计算依据的数据应是0.255g、280mL,具体计算时可利用“电子”守恒:设0.255g合金中含Mg xmol,含Al ymol,则:
解得: ∴ n(Mg)∶n(Al)=1∶1 (4)当加入一定体积NaOH溶液后,铝元素全部以AlO2-存在,Mg2+刚好沉淀完全,说明溶液中溶质为NaCl、NaAlO2。由于合金中镁铝的物质的量之比为1∶1,所以可设丙中Mg、Al各为zmol。则有: 24z+27z=0.459,z=0.009mol 根据“Cl”守恒有: n(NaCl)=n(HCl)=1´0.03mol=0.03mol 根据“Al”守恒有: n(NaAlO2)=n(Al)=0.009mol 根据“Na”守恒有: n(NaOH)=n(NaCl)+n(NaAlO2)=(0.03+0.009)mol=0.039mol ∴ V(NaOH)= 答案 (1)过量,不足量 (2)30mL、336mL,1 (3)0.255g、280mL,1∶1 (4)0.009,0.03,39
|

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案