题目内容
5.某炼袖厂每日可制得乙烯8.96×104m3(标准状况),若这些乙烯全部用来制取乙醇,在转化率为99%的情况下,可制得95%的酒精多少吨?分析 发生反应为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,根据n=$\frac{V}{{V}_{m}}$=计算出乙烯的物质的量,然后根据反应方程式、转化率计算出生成95%的酒精的质量.
解答 解:标准状况下8.96×104m3的物质的量为:$\frac{8.96×1{0}^{7}L}{22.4L/mool}$=4×106mol,
乙烯与水反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,该反应中乙烯的转化率为99%,则反应生成乙醇的物质的量为:4×106mol×99%=3.96×106mol,
生成95%的乙醇的物质的量为:$\frac{3.96×1{0}^{6}mol}{95%}$=4.17×106mol,其质量为:46g/mol×4.17×106mol=191.8×106g=191.8t,
答:该乙烯完全反应可制得95%的酒精191.8吨.
点评 本题考查了化学方程式的计算,题目难度中等,明确转化率、质量分数的含义为解答关键,注意掌握发生反应的原理,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.下列物质中既含有离子键又含有共价键的是( )
| A. | H2O | B. | CH3CH2OH | C. | Na2O | D. | NaOH |
16.下列有机物命名正确的是( )


| A. | 2-甲基-3-丁炔 | B. | 2-甲基-1-丙醇 | C. | 2-甲基丁烷 | D. | 二氯丙烷 |
13.下列转化不能一步实现的是( )
| A. | CuO→Cu(OH)2 | B. | Cu→CuSO4 | C. | MgSO4→MgCl2 | D. | NaCl→NaOH |
20.某同学在化学实验准备室中发现一瓶露置于空气已久的Ba(OH)2•8H2O试剂.
I.初步推测
(1)室温配制溶液时,发现所取试剂在水中仅部分溶解,烧杯中存在未溶物.并推测未溶物为BaCO3,理由(用化学方程式表示)Ba(OH)2•8H2O+CO2=BaCO3+9H2O.
II.成分检验
假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计实验方案,进行成分检验(不考虑结晶水的检验;室温时BaCO3饱和溶液pH=9.6).
[限选试剂及仪器]
稀盐酸、稀硫酸、NaOH溶液、澄清石灰水;pH计、烧杯、试管、带塞导气管、滴管
(2)请将步骤3填写完整滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,预期现象是试管中有气泡生成,烧杯中的澄清石灰水变浑浊.
(3)步骤2仅验证试剂中含有Ba2+离子,由此设计步骤4:取适量滤液于烧杯中用pH计测其pH值;若pH>9.6,说明有大量的OH-,说明试剂中有Ba(OH)2.
III.测定试剂中Ba(OH)2•8H2O的含量
(4)某同学拟用重量法测定:准确称取试剂于烧杯中,溶解,过滤.将BaCO3沉淀洗涤、干燥后称量,由此计算含量.该方法不可行的原因是:氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响.
(5)进一步完善测定方案如下:
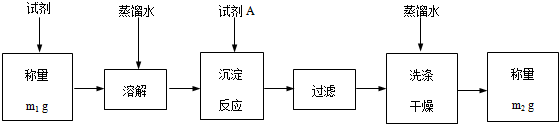
(1)试剂A为碳酸钠.过滤前,检验沉淀是否完全的操作是取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全.
(2)该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$(只列式).$\frac{315(m1-m2)}{118m1}$
(6)如果m1 g试剂反应后得到的沉淀的准确值为m3 g,则测定的相对误差为$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$;当相对误差为负值时,说明Ba(OH)2•8H2O的含量测定结果偏大(填:偏大或偏小).
I.初步推测
(1)室温配制溶液时,发现所取试剂在水中仅部分溶解,烧杯中存在未溶物.并推测未溶物为BaCO3,理由(用化学方程式表示)Ba(OH)2•8H2O+CO2=BaCO3+9H2O.
II.成分检验
假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计实验方案,进行成分检验(不考虑结晶水的检验;室温时BaCO3饱和溶液pH=9.6).
[限选试剂及仪器]
稀盐酸、稀硫酸、NaOH溶液、澄清石灰水;pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
(3)步骤2仅验证试剂中含有Ba2+离子,由此设计步骤4:取适量滤液于烧杯中用pH计测其pH值;若pH>9.6,说明有大量的OH-,说明试剂中有Ba(OH)2.
III.测定试剂中Ba(OH)2•8H2O的含量
(4)某同学拟用重量法测定:准确称取试剂于烧杯中,溶解,过滤.将BaCO3沉淀洗涤、干燥后称量,由此计算含量.该方法不可行的原因是:氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响.
(5)进一步完善测定方案如下:

(1)试剂A为碳酸钠.过滤前,检验沉淀是否完全的操作是取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全.
(2)该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$(只列式).$\frac{315(m1-m2)}{118m1}$
(6)如果m1 g试剂反应后得到的沉淀的准确值为m3 g,则测定的相对误差为$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$;当相对误差为负值时,说明Ba(OH)2•8H2O的含量测定结果偏大(填:偏大或偏小).
10.在某无色透明溶液中,能大量共存的离子组是( )
| A. | Na+、H+、CO32-、Cl- | B. | K+、H+、Cl-、SO42- | ||
| C. | Na+、Cu2+、SO42-、OH- | D. | H+、K+、HCO3-、Cl- |
14.利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是( )
 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3
②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2
⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2
⑧乙醇和浓硫酸制C2H4.
 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2
⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2
⑧乙醇和浓硫酸制C2H4.
| A. | ②③ | B. | ①⑥⑦ | C. | ②⑤⑧ | D. | ①④⑥ |
15.下列说法正确的是( )
| A. | Cu和浓硫酸在加热的条件下可以反应,体现浓硫酸的强氧化性和酸性 | |
| B. | 将SO2通入盛有品红溶液的试管中红色褪去,给试管加热无明显变化 | |
| C. | 将干燥的Cl2通入装有红色鲜花的试管中,红花褪色,说明Cl2具有漂白性 | |
| D. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,会产生白烟 |
 、
、 .
.