题目内容
下列试剂应该保存在棕色试剂瓶中的是
- A.碳酸氢铵
- B.氯化亚铁溶液
- C.浓硝酸
- D.漂白粉
C
分析:见光易分解的药品要保存在棕色试剂瓶中,易分解的物质要阴暗处保存,易和空气中成分发生化学反应的物质要密封保存.
解答:A、温度高时,碳酸氢铵易分解,所以要存放在阴暗处保存,故A错误;
B、氯化亚铁易被空气中氧气氧化而变质,所以要密封保存,故B错误;
C、浓硝酸见光易分解生成二氧化氮、水和氧气,所以要保存在棕色试剂瓶中,故C正确;
D、漂白粉易和二氧化碳反应而变质,所以要密封保存,故D错误;
故选C.
点评:本题考查化学试剂的保存,题目难度不大,注意化学试剂的保存与化学试剂的性质有关.
分析:见光易分解的药品要保存在棕色试剂瓶中,易分解的物质要阴暗处保存,易和空气中成分发生化学反应的物质要密封保存.
解答:A、温度高时,碳酸氢铵易分解,所以要存放在阴暗处保存,故A错误;
B、氯化亚铁易被空气中氧气氧化而变质,所以要密封保存,故B错误;
C、浓硝酸见光易分解生成二氧化氮、水和氧气,所以要保存在棕色试剂瓶中,故C正确;
D、漂白粉易和二氧化碳反应而变质,所以要密封保存,故D错误;
故选C.
点评:本题考查化学试剂的保存,题目难度不大,注意化学试剂的保存与化学试剂的性质有关.

练习册系列答案
相关题目
某兴趣小组探究以卤水为原料制取Br2原理.
(1)甲同学设计以卤水为原料制取Br2实验,流程如图1,其中操作1使用的试剂是______,所用的玻璃仪器名称是______.
(2)要想除去液溴中少量Cl2,可在液溴中加入______(填序号)后再萃取分液即可.
①亚硫酸钠溶液 ②浓NaOH溶液 ③氢溴酸
(3)乙同学提出工业从海水中提取溴的过程如图2,其中操作1已获得Br2,操作2又将Br2还原为Br-,其目的为______.

(4)上述操作2用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______.为了解从工业溴中提纯溴的方法,他们查阅了有关资料见下表,后设计实验装置如下图:
| 溴 | 物理性质 | 暗红色液体,刺激性气味.室温下易挥发.熔点-7.2℃,沸点59.1℃.密度2.928g?cm-3.稍溶于冷水. |
| 化学性质 | 溶于水生成次溴酸 |

(5)蒸馏装置连接部分都用磨口玻璃接口,而不用橡胶管和橡胶塞连接,是因为:______,图中仪器B的名称:______.
(6)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:______.C中液体产物颜色为______.
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下
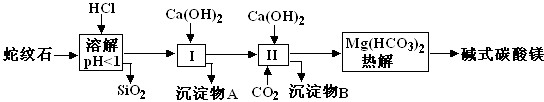
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致______溶解、______沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______ (填入物质的化学式),然后______ (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是______(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值(已知均为正整数),请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③______ ④______ ⑤称出MgO的质量.
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-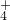 +OH-
+OH- NH3↑+H2O
NH3↑+H2O