题目内容
13.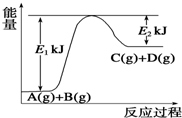 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.(1)该反应是吸热反应(填“吸热”或“放热”),该反应的△H=E1-E2 kJ•mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量一定低(填“一定高”、“一定低”或“高低不一定”).
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1减小,E2减小,△H不变(填“增大”、“减小”或“不变”).
(3)已知:①2CO(g)+4H2(g)═2CH4(g)+O2(g)△H=+71kJ•mol-1
CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ•mol-1;
②CH4(g)的燃烧热为-890kJ•mol-1.
写出表示CH3OH(l)燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764kJ•mol-1.
分析 (1)根据反应物与生成物总能量大小判断,根据△H=反应物的总键能-生成物的总键能;
(2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(3)在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol,结合盖斯定律进行计算.
解答 解:(1)由图象可知该反应是一个能量升高的反应,所以属于吸热反应;△H=反应物的总键能-生成物的总键能,所以△H=E1-E2;由图象可知可知该反应是一个能量升高的反应,所以1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量低,
故答案为:吸热; E1-E2;一定低;
(2)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以E的大小对该反应的反应热无影响;
故答案为:减小;减小;不变;
(3)CH4(g)的燃烧热为-890 kJ•mol-1,即CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
已知:①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H1=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)△H2=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890kJ/mol
根据盖斯定律,③×2-①-②×2得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=2×(90.5kJ/mol)+2×(-890kJ/mol)+71kJ/mol=-1528kJ/mol,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764 kJ•mol-1,故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764 kJ•mol-1.1
点评 本题考查反应热的判断,△H的计算以及盖斯定律的应用,难度适中,注意催化剂对活化能和反应热的影响.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 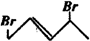 | B. | 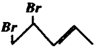 | C. |  | D. |  |
| A. | C2H5Cl | B. | C4H8 | C. | C6H6 | D. | C3H6O |
| A. | BaCl2 | B. | H2SO4 | C. | KOH | D. | HCl |
| A. | 铝片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | NaOH与HCl反应 | D. | 食物的缓慢氧化 |
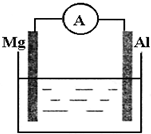 如图所示装置
如图所示装置 