题目内容
1886年,德国夫赖堡(Frieberg)矿业学院的一位教授在分析夫赖堡附近发现的一种新矿石(以X表示,X为整比化合物)的时候,发现其中有一种当时未知的新元素(以Y表示,在X中Y的化合价为+4),并通过实验验证了自己的推断.经分析,X中含有银元素(化合价为+1)和硫元素(化合价为-2),其中Ag的质量分数为76.53%.在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2).如果在200℃和100kPa条件下完全转化16.0g的X需要0.557L的氢气.根据上面的描述:
(1)计算Y的摩尔质量并指出Y在元素周期表中的位置
(2)写出X的化学式
(3)写出氢气和X反应的化学方程式 .
(1)计算Y的摩尔质量并指出Y在元素周期表中的位置
(2)写出X的化学式
(3)写出氢气和X反应的化学方程式
考点:化学方程式的有关计算
专题:信息给予题
分析:(1)设X的化学式为Ag2aYbSa+2b,
=76.53%,M(X)=
,参加反应的氢气的物质的量是n(H2)=100×
×8.31=0.01417 mol,根据Ag2aYbSa+2b +b H2 =a Ag2S+b YS+b H2S计算
=4.00,因X是正比化合物,a、b都是正整数,得a=4,b=1,M(Y)=73 g/mol,查元素周期表可得Y是Ge元素;
(2)由(1)可知设X的化学式为Ag2aYbSa+2b,a=4,b=1,Y是Ge元素,则X的化学式为Ag8GeS6;
(3)Ag8GeS6在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)GeS,由此书写化学方程式.
| 216a |
| M(X) |
| 216a |
| 0.7653 |
| 0.557 |
| 473 |
| a |
| b |
(2)由(1)可知设X的化学式为Ag2aYbSa+2b,a=4,b=1,Y是Ge元素,则X的化学式为Ag8GeS6;
(3)Ag8GeS6在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)GeS,由此书写化学方程式.
解答:
解:(1)设X的化学式为Ag2aYbSa+2b,
=76.53%,M(X)=
,参加反应的氢气的物质的量是n(H2)=100×
×8.31=0.01417 mol,
Ag2aYbSa+2b +b H2 =a Ag2S+b YS+b H2S
b
16.0 0.01417
=4.00,因X是正比化合物,a、b都是正整数,得a=4,b=1,M(Y)=73 g/mol,查元素周期表可得Y是Ge元素,它的位置是第四周期ⅣA族,
故答案为:第四周期ⅣA族;
(2)由(1)可知设X的化学式为Ag2aYbSa+2b,a=4,b=1,Y是Ge元素,则X的化学式为Ag8GeS6,
故答案为:Ag8GeS6;
(3)Ag8GeS6在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)GeS,化学方程式为Ag8GeS6+H2
4Ag2S+H2S+GeS,
故答案为:Ag8GeS6+H2
4Ag2S+H2S+GeS.
| 216a |
| M(X) |
| 216a |
| 0.7653 |
| 0.557 |
| 473 |
Ag2aYbSa+2b +b H2 =a Ag2S+b YS+b H2S
| 216a |
| 0.7653 |
16.0 0.01417
| a |
| b |
故答案为:第四周期ⅣA族;
(2)由(1)可知设X的化学式为Ag2aYbSa+2b,a=4,b=1,Y是Ge元素,则X的化学式为Ag8GeS6,
故答案为:Ag8GeS6;
(3)Ag8GeS6在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)GeS,化学方程式为Ag8GeS6+H2
| ||
故答案为:Ag8GeS6+H2
| ||
点评:本题考查了化学方程式的计算、化学式的确定、化学方程式的书写等知识,难度中等,侧重于计算能力和元素周期表的认知能力的考查.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
某种干洗剂的主要成分是四氯乙烯,对人体有害.家用不粘锅内涂覆物质的主要成分是聚四氟乙烯,对人体无害.下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是( )
| A、它们都属于高分子化合物 |
| B、它们的分子中都不含氢原子 |
| C、它们都能使酸性KMnO4溶液褪色 |
| D、它们都可由乙烯只发生加成反应得到 |
煤矿一旦发生爆炸事故,会造成重大人员伤亡和财产损失.煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷.下列关于甲烷的叙述中错误的是( )
| A、“西气东输”中的天然气的主要成分为甲烷 |
| B、甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
| C、甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D、“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
利用下列实验装置及药品(依次为①-④)能完成相应实验的是( )
A、 实验测定化学反应速率 |
B、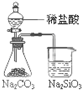 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |
下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A、乙烯和环丙烷 |
| B、CH≡C-CH3和CH2=CH-CH=CH2 |
| C、2,2-二甲基丙烷和2-甲基丁烷 |
| D、乙烯和丙烯 |
如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )

| A、X极是电源的负极,Y极是电源的正极 |
| B、Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体 |
| C、电解过程中CuSO4溶液的pH逐渐增大 |
| D、a极的电极反应式为2Cl--2e-═Cl2↑ |

