题目内容
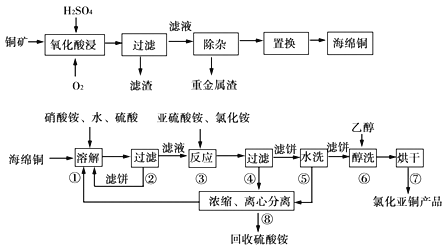
【题目】工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
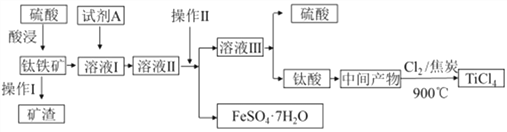
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。
【答案】 +4 铁粉(或 Fe) A 结晶、过滤 6 2Cl2 +TiO2 +C ![]() TiCl4 + CO2 (产物为 CO 也可) ① C 与 O2反应减小 O2的浓度使平衡向右移动 ②C与O2反应放热, 温度升高使平衡向右移动, 促使反应顺利进行 TiCl4 +(x+2)H2O ==TiO2·xH2O + 4HCl
TiCl4 + CO2 (产物为 CO 也可) ① C 与 O2反应减小 O2的浓度使平衡向右移动 ②C与O2反应放热, 温度升高使平衡向右移动, 促使反应顺利进行 TiCl4 +(x+2)H2O ==TiO2·xH2O + 4HCl
【解析】(1)由反应方程式可得,FeTiO3和H2SO4反应生成FeSO4、TiOSO4和H2O,该反应为非氧化还原反应,Fe元素化合价为+2价,根据化合物中正负化合价代数和为0,可知FeTiO3中钛元素的化合价为+4。
(2)溶液I为FeSO4和TiOSO4的混合溶液,通过后续流程中的物质可以判断,加入试剂A后并没有引入新元素,又因为经过操作II得到了FeSO4·7H2O,而亚铁离子容易被氧化,所以试剂A为铁粉(或Fe);加入A的目的是防止Fe2+被氧化。操作II从溶液得到FeSO4·7H2O晶体,所以操作II除了浓缩、冷却外,还有结晶、过滤。
(3)Q=c(Fe2+)×c2(OH-)=0.49×c2(OH-)<Ksp[Fe(OH)2]=4.9×10-17时不会生成Fe(OH)2沉淀,则c(OH-)<10-8,c(H+)=Kw/c(OH-)>10-6,所以pH不超过6。
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)![]() TiO2(s)+H2O(g),上述工艺流程中钛酸煅烧得到的中间产物与Cl2和焦炭在900℃时反应生成TiC14,所以生成TiCl4化学方程式为:2Cl2+TiO2+C
TiO2(s)+H2O(g),上述工艺流程中钛酸煅烧得到的中间产物与Cl2和焦炭在900℃时反应生成TiC14,所以生成TiCl4化学方程式为:2Cl2+TiO2+C ![]() TiCl4+CO2(或者2Cl2+TiO2+2C
TiCl4+CO2(或者2Cl2+TiO2+2C ![]() TiCl4+2CO)。若要TiO2(s)与Cl2(g)高温条件直接反应生成TiC14(l)和O2(g),该反应极难进行,当向反应体系中加入焦炭后,根据化学平衡移动原理:①C与O2反应减小了O2的浓度使平衡向右移动,②C与O2反应放热,温度升高使平衡向右移动,促使反应顺利进行。
TiCl4+2CO)。若要TiO2(s)与Cl2(g)高温条件直接反应生成TiC14(l)和O2(g),该反应极难进行,当向反应体系中加入焦炭后,根据化学平衡移动原理:①C与O2反应减小了O2的浓度使平衡向右移动,②C与O2反应放热,温度升高使平衡向右移动,促使反应顺利进行。
(5)利用TiCl4水解制TiO2·xH2O,根据原子守恒,该反应的化学方程式为:TiCl4+(x+2)H2O=TiO2xH2O+4HCl。

 阅读快车系列答案
阅读快车系列答案