题目内容
1.下列叙述中错误的是( )| A. | 稳定性:HF>HCl>HBr | B. | 还原性:Na>Mg>Al | ||
| C. | 原子半径:Cl>S>O | D. | 酸性:HClO4>H2SO4>H3PO4 |
分析 A.同主族元素从上到下非金属性依次减弱,气态氢化物稳定性依次减弱;
B.同周期元素,从左到右金属性依次减弱,单质还原性依次减弱;
C.电子层越多,半径越大,同周期从左向右原子半径在减小;
D.同周期元素,从左到右非金属性依次增强,非金属性越强,则最高价氧化物的水化物的酸性越强.
解答 解:A.F、Cl、Br是同主族元素,.非金属性:F>Cl>Br,对应的氢化物越稳定,则有HF>HCl>HBr,故A正确;
B.同周期从左向右金属性减弱,则还原性Na>Mg>Al,故B正确;
C.电子层越多,半径越大,则O原子半径最小,同周期从左向右原子半径在减小,则S>Cl,故C错误;
D.非金属性Cl>S>P,则最高价氧化物的水化物的酸性为HClO4>H2SO4>H3PO4,故D正确;
故选:C.
点评 本题考查元素周期表和元素周期律,熟悉同周期、同主族元素的性质变化规律即可解答,难度不大.

练习册系列答案
相关题目
11.下列物质属于纯净物的是( )
| A. | 硬铝 | B. | 不锈钢 | C. | 胆矾 | D. | 铝热剂 |
9.下列方法或操作不能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性 强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 证明CH2=CHCHO中含有碳碳双 键 | 滴入KMn04酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作 用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有 沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充 分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgN03溶液 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
16.下列化合物中,同分异构体数目超过7的有(包括自己)( )
| A. | 丁醇 | B. | 乙酸乙酯 | C. | 1,2-二溴丙烷 | D. | 戊烷 |
14.用石墨作电极电解CuCl2和KCl的混合溶液,电解初期阴极和阳极分别析出的物质是( )
| A. | H2、Cl2 | B. | Cu、Cl2 | C. | H2、O2 | D. | Cu、O2 |
 Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.上述实验判断有乙醛生成的现象为铜丝由黑变红,并产生刺激性气味
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.上述实验判断有乙醛生成的现象为铜丝由黑变红,并产生刺激性气味
 ;
; 和
和 ;
;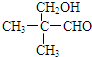 .
.