题目内容
12.若A+酸═盐+水,则A不可能属于( )| A. | 单质 | B. | 氧化物 | C. | 碱 | D. | 电解质 |
分析 碱性氧化物、碱都能酸反应生成盐和水,金属单质和酸反应生成盐和氢气或含氮气体,在水溶液里或熔融状态下能导电的化合物是电解质.
解答 解:A.金属单质和酸反应可能生成盐和氢气,也可能生成含氮物质,如铁和过量硝酸反应生成盐、水和一氧化氮,所以A不可能是单质,故A正确;
B.碱性氧化物和酸反应生成盐和水,所以A可能是氧化物,故B错误;
C.碱和酸发生中和反应生成盐和水,所以A可能是碱,故C错误;
D.碱及金属氧化物都属于电解质,能和酸反应生成盐和水,所以A可能是电解质,故D错误;
故选A.
点评 本题根据反应类型确定反应物,明确物质的性质是解本题关键,知道哪些物质能和酸反应生成盐和水,易错选项是A,注意金属和硝酸反应的生成物特点,为易错点,题目难度中等.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
3.下列推断正确的是( )
| A. | SiO2、NO2都能与NaOH溶液反应,都是酸性氧化物 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 为增大氯水中c(HClO),应采取的措施是加入CaCO3固体 | |
| D. | 铁、铝容器常温下可盛放浓硫酸,是因为常温下铁、铝与浓硫酸不反应 |
20.N、P等同主族元素形成的同一类型化合物,往往其结构和性质相似.下列对PH4Cl的叙述中,正确的是( )
| A. | 它是一种共价化合物 | B. | 它既含离子键又含共价键 | ||
| C. | 它可能能与NaOH溶液反应 | D. | 它与H2O2所含化学键完全相同 |
7.将ag纯铜片投入足量的一定浓度的硝酸溶液中,反应中消耗的HNO3为bg.若a:b=8:21,则反应中起酸性作用的硝酸的质量为( )
| A. | $\frac{b}{2}$ g | B. | 2b g | C. | $\frac{3}{4}$a g | D. | $\frac{3}{4}$b g |
17.将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 生成的乙酸乙酯中含有18O | |
| B. | 能生成乙酸乙酯的质量为88g | |
| C. | 生成乙酸乙酯的质量为90g | |
| D. | 反应后的混合物中有两种物质含18O |
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 mol甲醇中含有C-H键的数目为4NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol丙烯酸中含有双键的数目为NA |
1.下列叙述中,不正确的是( )
| A. | 常温下铝在浓硫酸中钝化 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分金属的熔点都低 | |
| D. | 工业上常利用铝热反应冶炼难熔的金属 |
13.下列排列顺序不正确的是( )
| A. | 非金属性:F>Cl>S | B. | 熔点:I2>H2O>H2S | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |
 .
.
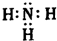 .化合物X的电子式
.化合物X的电子式 .
.