题目内容
2.短周期主族元素W、X、Y、Z在元素周期表中的相对位置如图所示.其中Y所处的周期序数与族序数相等,常温下,W和Z的单质均为气态.下列说法不正确的是( )| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
分析 Y所处的周期序数与族序数相等,为短周期元素,则Y为第三周期第ⅢA族元素,为Al元素,X为Mg元素,则常温下,W和Z的单质均为气态,W为F元素、Z为Cl元素,结合元素周期律知识进行判断.
解答 解:Y所处的周期序数与族序数相等,为短周期元素,则Y为第三周期第ⅢA族元素,为Al元素,X为Mg元素,则常温下,W和Z的单质均为气态,W为F元素、Z为Cl元素,
A.电子层越多,离子半径越大,具有相同电子排布的离子原子序数大的离子半径小,则离子半径:Z>W>X>Y,故A错误;
B.非金属性W>Z,则气态氢化物的稳定性W>Z,故B正确;
C.元素X与Z形成的化合物为氯化镁,只含有离子键,故C正确;
D.金属性X>Y,最高价氧化物对应水化物的碱性X>Y,故D正确;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
12.下列物质不是常见的室内污染物是( )
| A. | 甲苯 | B. | 甲醛 | C. | NO2 | D. | 氡 |
13.砖瓦是用含铁等元素的黏土隔绝空气烧制而成的.当烧窑作业临近结束时,若用淋水的办法来降低温度,窑内处于还原性气氛,则砖呈青色,称青砖.若用捅开窑顶自然冷却的办法,则砖呈红色,称红砖.由此判断砖块中的成分,错误的是( )
| A. | 砖块中的主要成分是硅酸盐 | |
| B. | 青砖中的铁元素主要以氢氧化亚铁的形式存在 | |
| C. | 红砖中的铁元素主要以氧化铁的形式存在 | |
| D. | 青砖中的铁元素主要以氧化亚铁的形式存在 |
10.化学与工农业生产有密切的联系.下列说法中正确的是( )
| A. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| B. | 淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| D. | 北京奥运吉祥物“福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl |
17.某链状有机物分子中含有m个-CH3,n个-CH2,a个-CH-,其余为-NH2,则-NH2的数目可能是( )
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
7.某电池反应为2Al+6H+=2Al3++3H2↑,下列对该电池推断不正确的是( )
| A. | 铝为负极,镁为正极 | B. | 正极反应式为2H++2e-═H2↑, | ||
| C. | 放电时间越长,溶液中c(H+)越小 | D. | 电解质溶液不可能是硝酸 |
2.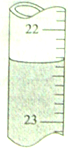 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
(1)其中第一次滴定达到终点时,滴定管中的液面如上图所示,其正确的读数是22.40mL.
(2)排去酸式滴定管中气泡的具体操作是将酸式滴定管稍稍倾斜,迅速打开活塞,气泡随溶液的流出而被排出;.
(3)根据以上数据可计算出NaOH溶液的物质的量浓度为0.15mol/L.(精确到0.01)
(4)滴定到终点时锥形瓶中溶液的颜色变化是由黄色变为橙色.
(5)下列操作会导致待测NaOH溶液浓度偏高的是AC(填序号).
A.滴定管用蒸馏水洗后未用标准酸液润洗,直接装入标准酸液
B.滴定管读数时,滴定前仰视滴定后俯视
C.滴定前滴定管尖端有气泡,滴后气泡消失
D.滴定到终点附近时,用少量蒸馏水冲洗锥形瓶内壁上沾附的溶液.
 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:| HCl溶液起始读数 | HCl溶液终点读数 | |
| 第一次 | 2.15mL | |
| 第二次 | 3.10mL | 21.85mL |
| 第三次 | 4.20mL | 22.95mL |
(2)排去酸式滴定管中气泡的具体操作是将酸式滴定管稍稍倾斜,迅速打开活塞,气泡随溶液的流出而被排出;.
(3)根据以上数据可计算出NaOH溶液的物质的量浓度为0.15mol/L.(精确到0.01)
(4)滴定到终点时锥形瓶中溶液的颜色变化是由黄色变为橙色.
(5)下列操作会导致待测NaOH溶液浓度偏高的是AC(填序号).
A.滴定管用蒸馏水洗后未用标准酸液润洗,直接装入标准酸液
B.滴定管读数时,滴定前仰视滴定后俯视
C.滴定前滴定管尖端有气泡,滴后气泡消失
D.滴定到终点附近时,用少量蒸馏水冲洗锥形瓶内壁上沾附的溶液.
19. 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(g)△H1反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g),△H=(△H1+△H2)kJ/mol,(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
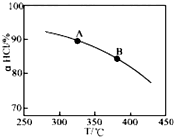
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl-T曲线如图,则总反应的△H<0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应aHCl-T(HCl的转化率与温度的关系)曲线的示意图,并简要说明理由: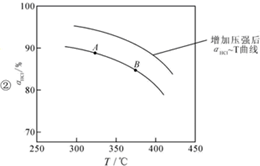 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
③下列措施中有利于提高aHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol•min-1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,(1)传统上该转化通过如图所示的催化剂循环实现,其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(g)△H1反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g),△H=(△H1+△H2)kJ/mol,(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl-T曲线如图,则总反应的△H<0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应aHCl-T(HCl的转化率与温度的关系)曲线的示意图,并简要说明理由:
 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.③下列措施中有利于提高aHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
20.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a=7(填“>”、“<”或“=”),则HA为强酸;
若a>7(填“>”、“<”或“=”),则HA为弱酸.
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是C
A.前者大 B.后者大C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a=7(填“>”、“<”或“=”),则HA为强酸;
若a>7(填“>”、“<”或“=”),则HA为弱酸.
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是C
A.前者大 B.后者大C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是弱酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.