题目内容
11.下列实验操作能达到实验目的是( )| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到热饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | “侯氏制碱法”过程中制取NaHCO3 | 将过量CO2通入到NH3和食盐的饱和溶液中 |
| D | 证明CH3COOH是弱酸 | 将CH3COOH与Na2CO3溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀;
B.加热促进水解,生成HCl易挥发;
C.过量CO2通入到NH3和食盐的饱和溶液中,生成碳酸氢钠,其溶解度小;
D.CH3COOH与Na2CO3溶液反应,为强酸制取弱酸的反应.
解答 解:A.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀,应在沸水中滴加氯化铁溶液制备胶体,故A错误;
B.加热促进水解,生成HCl易挥发,不能蒸干制备,应选冷却结晶法制备,故B错误;
C.过量CO2通入到NH3和食盐的饱和溶液中,生成碳酸氢钠,其溶解度小,则析出碳酸氢钠,故C正确;
D.CH3COOH与Na2CO3溶液反应,为强酸制取弱酸的反应,不能说明醋酸为弱酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、胶体制备、盐类水解、酸性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
2.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | A与C形成的化合物溶于水所得溶液显碱性 | |
| B. | B与D形成的化合物溶于水所得溶液显酸性 | |
| C. | 氢化物的稳定性:C>D | |
| D. | 简单离子的半径:B>C>D>A |
6.聚甲基丙烯酸甲酯的(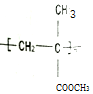 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
16.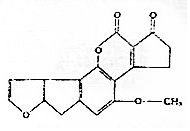 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
3.在Ag+催化作用下,Cr3+被S2O82-氧化为Cr2O72-的机理为:S2O82-+2Ag+=2SO42-+2Ag2+ 慢2Cr3++6Ag2++7H2O=6Ag++14H++Cr2O72-快下列有关说法正确的是( )
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
9.类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分.探究过程如下:
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
10.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 最外层电子数Li<Mg<Si<Ar |