题目内容
12.25℃下,0.1mol/L醋酸为的电离度为1%,则此温下,该溶液的pH=3,电离平衡常数为10-5,水电离出的c(H+)=10-11mol/L.分析 根据电离度计算氢离子浓度,再求出pH;K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$;水电离的氢离子浓度等于水电离的氢氧根离子,结合Kw计算.
解答 解:25℃下,0.1mol/L醋酸为的电离度为1%,则此温下,c(H+)=0.1mol/L×1%=0.001mol/L,则该溶液的pH=3;
K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.00{1}^{2}}{0.1-0.001}$≈10-5;
溶液中水电离的氢氧根离子浓度为c(OH-)=$\frac{1{0}^{-14}}{0.001}$=10-11mol/L,水电离的氢离子浓度等于水电离的氢氧根离子,则水电离出的c(H+)=10-11mol/L,
故答案为:3;10-5;10-11mol/L.
点评 本题考查了pH的简单计算、电离常数的计算等,题目难度不大,注意把握电离常数的表达式和计算方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.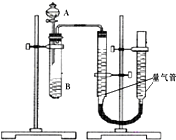 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
(1)该实验的目的是探究草酸浓度和催化剂对化学反应速率的影响.
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(4)X=A
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(2)分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4溶液过量.
3.有①甲醇、②乙醛、③苯、④聚乙烯、⑤苯酚、⑥环己烷、⑦邻二甲苯、⑧环己烯(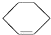 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
20.某有机物6.4g在氧气中完全燃烧,生成8.8gCO2和7.2g水,下列说法正确的是( )
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
17. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①下列说法正确的是BC.
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)下列措施中能使平衡常数K增大的是a(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8min内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(4)1 100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mol CO2 | 4mol FeO、3mol CO |
| CO的浓度(mol•L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=0.67mol•L-1、φ1=33.3%、α2=55.5%.
4.下列实验操作,对实验结果不会产生影响的是( )
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
1.下列物质属于不等电子体的是( )
| A. | CH4和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、N2O | D. | H2O和CH4 |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.