��Ŀ����
��Ʒ�Һ��Cr2O72����ͨ�����з�Ӧת���ɸ��ƣ�PbCrO4����
Cr2O72����aq��+ 2Pb2+��aq��+ H2O��l��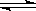 2PbCrO4��s��+ 2H+��aq����H��0
2PbCrO4��s��+ 2H+��aq����H��0
�÷�Ӧ��ƽ��ı�����������˵����ȷ����
| A�����߲���PbCrO4���壬Cr2O72��ת�������� |
| B�������¶ȣ��÷�Ӧ��ƽ�ⳣ����K������ |
| C����������NaOH���壬��Ȼ��������Һ��ɫ��dz |
| D����������K2Cr2O7�������Һ��c(H+)���� |
C
�������������A��PbCrO4Ϊ��̬�����߲���PbCrO4���壬��ѧƽ�ⲻ�ƶ�������Cr2O72��ת���ʲ��䣬����B���÷�ӦΪ���ȷ�Ӧ�����������¶ȣ�ƽ�������ƶ�����ƽ�ⳣ����С������C����������NaOH���壬��H+��Ӧ��ƽ�������ƶ���Cr2O72��Ũ�ȼ�С����Һ��ɫ��dz����ȷ��D����������K2Cr2O7�����Cr2O72��Ũ������ƽ�������ƶ�����Һ��c(H+)������
���㣺���⿼�黯ѧƽ���ƶ���

��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ������
�������еμ�˫��ˮ��������Ӧ��H2O2+2H++2I��=2H2O+I2��
�����ɵ�I2�������Լ�X��Ӧ�����Լ�X����������ɵ� I2�Ż������۱�����ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㣺H2O2+2H++2I��= 2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0��1 mol��L��1 KI��Һ | H2O | 0��01 mol��L��1 X��Һ | 0��1mol��L��1 ˫��ˮ | 1 mol��L1 ϡ���� | |||
| 1 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | �� | 1��4 |
| 2 | 20��0 | m | 10��0 | 10��0 | n | �� | 2��8 |
| 3 | 10��0 | 20��0 | 10��0 | 20��0 | 20��0 | �� | 2��8 |
| 4 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | 5��Fe2(SO4)3 | 0��6 |
��1����֪��ʵ��1��2��Ŀ����̽��H2O2Ũ�ȶ�H2O2+2H++2I��= 2H2O+I2��Ӧ���ʵ�Ӱ�졣ʵ��2��m= ��n= ��
��2����֪��I2��X��ȫ��Ӧʱ���������ʵ���֮��Ϊ1��2���������е�X��KI�ļ�����������V��H2O2��>________����ȷ��������ɫ��
��3��ʵ��1��Ũ��c(X)�� t�ı仯������ͼ�������������������䣬���ڴ������ͼ�У��ֱ�ʵ��3��ʵ��4��c(X) �� t�ı仯����ͼ��������Ӧ�ı�ע����

��4��ʵ��4����������������߷�Ӧ���ʡ������ܼӿ췴Ӧ��������Ϊ���� (���ߡ����͡�)�˷�Ӧ��ܡ�
��5�������Ѻ����������������Ƴɹ�����֪����ܷ�ӦΪ��2Al(s)+3I2(s)
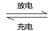 2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________����
2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________������6����֪��N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) ��H1= ��640kJ/mol
H2O��l��=H2O��g�� ��H2��+44.0kJ/mol
��0.25mol Һ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų��������� ��
������Ӱ�컯ѧ��Ӧ���ʵ������У���ʹ��ѧ��Ӧ���ʼӿ�ķ����ǣ� ��
�������¶� �ڼ������ ������Ӧ��Ũ�Ȣܽ���״���巴Ӧ��ĥ�ɷ�ĩ
| A���٢ڢ� | B���٢ڢ� | C���٢ۢ� | D���٢ڢۢ� |
��һ���¶��µĺ����ܱ������У���������Щ���������ٷ����仯ʱ������������ӦA(s)��2B(g)  C(g)��D(g)�Ѵﵽƽ��״̬�ٸ��������ʵ����ʵ���Ũ�Ȣ�����������ʵ����ۻ�������ѹǿ�ܻ��������ܶ�
C(g)��D(g)�Ѵﵽƽ��״̬�ٸ��������ʵ����ʵ���Ũ�Ȣ�����������ʵ����ۻ�������ѹǿ�ܻ��������ܶ�
| A��ֻ�Т٢� | B��ֻ�Т٢� | C��ֻ�Т٢ۢ� | D���٢ڢۢ� |
Ϊ��˵��Ӱ�컯ѧ��Ӧ���������أ��ס��ҡ�������4λͬѧ�ֱ����������4��ʵ�飬����Ϊ���۲���ȷ����(����)
| A������״����С����ͬ��þ������������ͬŨ�ȵ����ᷴӦʱ����������һ�� |
| B������ͬ�����£��������Ĵ���ʯ��ʹ���ʯ��ĩ����ͬŨ�ȵ����ᷴӦ������ʯ��ĩ��Ӧ�� |
| C����Ũ����ֱ�����䰵����ǿ�������£��ᷢ�ֹ��տ��Լӿ�Ũ����ķֽ� |
| D����ֻ�Թ��зֱ������ͬ����������أ�����һֻ�Թ����ټ��������������̣�ͬʱ���ȣ����������Ŀ�����ͬ |
��2L�ܱ������н��еķ�Ӧ2SO2(g)��O2(g) 2SO3(g)����10���ڷ�Ӧ��SO2�����ʵ�����1mol����0.6mol����Ӧ���ʦ�(O2)Ϊ�� ��
2SO3(g)����10���ڷ�Ӧ��SO2�����ʵ�����1mol����0.6mol����Ӧ���ʦ�(O2)Ϊ�� ��
| A��0.02mol/(L��s) | B��0.04mol/((L��s) | C��0.01mol/((L��s) | D��0.2mol/((L��s) |
������ͬ���¶ȣ����淴Ӧ 2A (g) + B��g��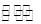 2C��g����1��105 Pa��1��106 Pa�����·� ��ﵽƽ��ʱ���淴Ӧ���ʣ�������ǰ����Ƚϣ� ��
2C��g����1��105 Pa��1��106 Pa�����·� ��ﵽƽ��ʱ���淴Ӧ���ʣ�������ǰ����Ƚϣ� ��
| A������ | B��С�� | C������ | D����ȷ�� |
�����¶ȣ��������ݲ�һ���������
A����ѧ��Ӧ����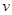 | B��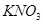 ���ܽ��S ���ܽ��S |
| C����ѧƽ�ⳣ��K | D��ˮ�����ӻ�����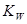 |
��ѧ��һֱ�����ڡ��˹��̵������·����о���Ŀǰ�ϳɰ�����ԭ��Ϊ��
N2(g) + 3H2(g) 2NH3(g)����H=��92.4kJ��mol��1����673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� ��
2NH3(g)����H=��92.4kJ��mol��1����673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� ��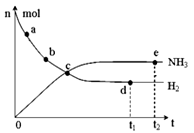
| A����a������Ӧ���ʱȵ�b�Ĵ� |
| B����c����Ӧ�ﵽ��ѧƽ��״̬ |
| C����d�͵�e����n(N2)����ͬ |
| D����e��Ӧ�ﵽ��ѧƽ��״̬����Ӧֹͣ |