题目内容
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
| A.只有①② | B.只有①④ | C.只有①③④ | D.①②③④ |
B
解析试题分析:①若各气体物质的物质的量浓度不变,则反应达到平衡状态,正确;②发生是反应前后气体体积相等的反应,则无论反应是否达到平衡,气体的总物质的量都不变,因此不能作为判断反应达到平衡的标志,错误;③若发生是在容积不变的容器中进行的反应前后气体体积相等的反应,则无论反应是否达到平衡,气体的总物质的量都不变,压强也不变,因此不能作为判断反应达到平衡的标志,错误;④由于反应前后气体的质量会发生变化,所以若混合气体的密度,则反应达到平衡状态,正确。
考点:考查可逆反应平衡状态的判断的知识。

在一定温度下,体积固定的密闭容器中,当下列物理量:①混合气体的压强 ② 气体的总物质的量 ③混合气体的密度 ④ B的物质的量浓度不再变化时,能表明可逆反应 A(s)+2B(g)  C(g)+D(g) 已达平衡的是 ( )
C(g)+D(g) 已达平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
在容积为VL的密闭容器中放入2LA和1LB,3A(g)+B(g)  nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
| A. 1 | B. 2 | C. 3 | D. 4 |
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
| A.0.02 mol·L-1·s-1 | B.1.8 mol·L-1·s-1 | C.1.2 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
| A.移走部分PbCrO4固体,Cr2O72-转化率升高 |
| B.升高温度,该反应的平衡常数(K)增大 |
| C.加入少量NaOH固体,自然沉降后,溶液颜色变浅 |
| D.加入少量K2Cr2O7固体后,溶液中c(H+)不变 |
在一定温度下的恒容容器中,标志反应A(s)+2B(g) 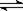 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强不随时间变化而变化 |
| B.混合气体的密度不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
| D.单位时间内生成n mol C,同时消耗2n mol B |
可逆反应N2(g)+ 3H2(g) 
 2NH3 (g)达到平衡状态,下列说法中正确的是( )
2NH3 (g)达到平衡状态,下列说法中正确的是( )
| A.该反应停止,N2和H2不再化合 | B.N2、H2、NH3浓度不变 |
| C.N2、H2、NH3浓度相等 | D.N2、H2、NH3的物质的量之比为1:3:2 |
 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)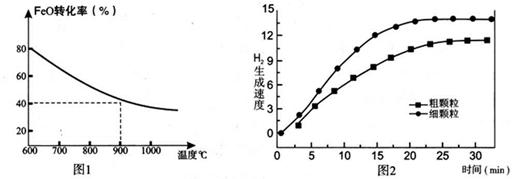
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。