题目内容
9.下列反应的离子方程式书写正确的是( )| A. | 氨气溶于醋酸溶液:NH3+H+→NH4+ | |
| B. | 将硫化氢气体通入足量氢氧化钠溶液中,H2S+2OH-→S2-+2H2O | |
| C. | 向氯化亚铁溶液中加入溴水:Fe2++Br2→Fe3++2Br- | |
| D. | 碳酸氢钠溶液中加入足量的石灰水:2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.氢氧化钠质量,反应生成氯化钠和水;
C.离子方程式两边总电荷不相等,违反了电荷守恒;
D.氢氧化钙足量,反应生成碳酸钙沉淀、氢氧化钠和水.
解答 解:A.醋酸需要保留分子式,正确的离子方程式为:NH3+CH3COOH=H3COO-+NH4+, 故A错误;
B.将硫化氢气体通入足量氢氧化钠溶液中,反应的离子方程式升温:H2S+2OH-=S2-+2H2O,故B正确;
C.向氯化亚铁溶液中加入溴水,二者发生氧化还原反应,正确的离子方程式为:2Fe2++Br2=2Fe3++2Br-,故C错误;
D.碳酸氢钠溶液中加入足量的石灰水,碳酸氢根离子完全转化成碳酸钙沉淀,正确的离子方程式为:HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.已知A、B、C、D是短周期中原子序数依次增大的四种主族元素.A2在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显碱性 |
17.下列实验操作及现象能够达到对应实验目的是( )
| 实验操作及现象 | 实验目的 | |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaCO3)>KSP(BaSO4) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| A. | A | B. | B | C. | C | D. | D |
4.下列对同系物归纳错误的是( )
| A. | 同系物都符合同一通式 | |
| B. | 同系物彼此在组成上相差一个或若干个某种原子团 | |
| C. | 同系物具有相同的最简式 | |
| D. | 同系物的结构相似 |
14.黄酒在存放过程中,有部分乙醇转化为乙酸,导致黄酒变酸.该过程中发生的反应为( )
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 酯化反应 |
1.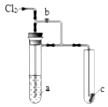 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )| A. | 浓FeCl2溶液 | B. | 饱和KI溶液 | C. | 饱和食盐水 | D. | 浓NaOH溶液 |
18.下列关于实验操作的叙述正确的是( )
| A. | 酸碱滴定时,眼睛一定要注视滴定管中液面的变化 | |
| B. | 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 | |
| C. | 测溶液酸碱性时,须将PH试纸浸入待测液中 | |
| D. | 分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出 |
19.下列工业生产的条件选择与勒沙特列原理无关的是( )
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 硫酸工业接触室中使用过量空气 | |
| C. | 合成氨工业采用20~50 MPa高压 | |
| D. | 侯氏制碱法向母液中加入氯化钠提取氯化铵 |