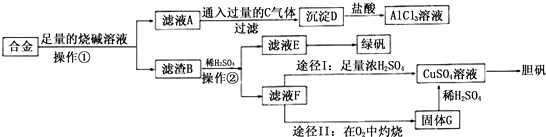
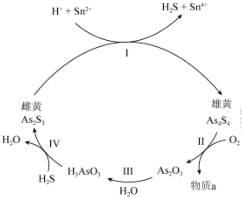
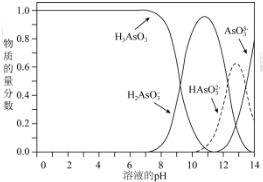
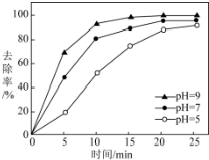
题目内容
15.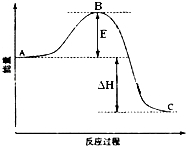 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:(1)图中A表示反应物总能量C表示成物总能量,E的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”还是“降低”),△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂改变了反应的历程使活化能E降低,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热
(2)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5.写出该催化循环机理的化学方程式SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5.
分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;加入催化剂,催化剂改变了反应的历程使活化能E降低,但不能改变反应物的总能量和生成物的总能量之差;
(2)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关;催化剂改变了反应的历程使活化能E降低,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
故答案为:反应物总能量;成物总能量;无;降低;不变;因为催化剂改变了反应的历程使活化能E降低,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5,该催化循环机理的化学方程式为SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5,
故答案为:SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5.
点评 本题考查反应热与焓变,把握图象中的有关信息以及催化剂对活化能、反应热的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关系正确的是( )
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
3.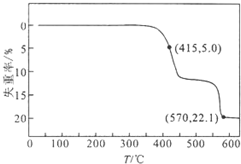 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、③的反应速率相等 |
20.下表是周期表中的一部分,根据A~M在周期表中的位置,回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,氧化性最强的单质是F2,还原性最强的单质是Na.(写元素符号或化学式)
(2)表中元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式为NaOH,酸性最强的化合物的化学式为HClO4,呈两性的化合物的化学式为Al(OH)3.
(3)A分别与B、C、D、E、J、K、L、M形成的化合物中最稳定的是HF(写化学式).
(4)写出D、G、L对应的离子半径由大到小的顺序:S2->O2->Na+(用离子符号表示).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | F | |||
| 3 | G | H | I | J | K | L | M |
(2)表中元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式为NaOH,酸性最强的化合物的化学式为HClO4,呈两性的化合物的化学式为Al(OH)3.
(3)A分别与B、C、D、E、J、K、L、M形成的化合物中最稳定的是HF(写化学式).
(4)写出D、G、L对应的离子半径由大到小的顺序:S2->O2->Na+(用离子符号表示).
7.下列离子中半径最大的是( )
| A. | O2? | B. | F- | C. | Mg2+ | D. | Al3+ |
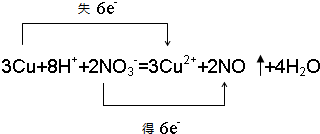 ,在这反应中该强酸展现酸性,氧化性.
,在这反应中该强酸展现酸性,氧化性.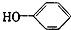 合成
合成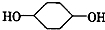 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)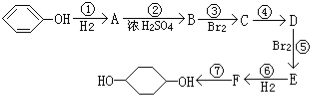
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.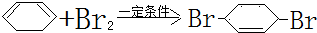 ,写出在同样反应条件下
,写出在同样反应条件下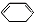 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)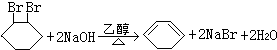 .
.