题目内容
17.下列电离方程式,书写正确的是( )| A. | Al2(SO4)3=2Al3++3SO42- | B. | AlCl3=Al3++Cl3- | ||
| C. | NaHCO3=Na++H++CO32- | D. | KMnO4=K++Mn7++4O2- |
分析 A.硫酸铝是强电解质完全电离;
B.氯离子书写不正确;
C.碳酸氢根离子为弱酸的酸式根离子,不拆;
D.高锰酸根离子为原子团不能拆;
解答 解:A.硫酸铝是强电解质完全电离,电离方程式:Al2(SO4)3=2Al3++3SO42-,故A正确;
B.氯化铝为强电解质,完全电离,电离方程式:AlCl3=Al3++3Cl-,故B错误;
C.碳酸氢钠为强电解质,完全电离,方程式:NaHCO3=Na++HCO3-,故C错误;
D.高锰酸钾为强电解质,完全电离,电离方程式:KMnO4=K++MnO4-,故D 错误;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
相关题目
7.交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,因为酒中的乙醇分子能使橙红色的重铬酸钾变为绿色的物质.在K2Cr2O7中铬(Cr)元素的化合价是( )
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
8.核磁共振仪测定某有机物的结构,到如图所示的核磁共振氢谱,则该有机物可能是( )

| A. | C2H5OH | B. |  | C. |  | D. |  |
6.某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 电解CuCl2溶液,若阳极生成11.2L的气体,反应中转移电子为1 mol | |
| D. | 将表面有铜绿的铜器放入盐酸中浸泡,除去铜绿 |
7.设NA为阿伏加德罗常数值.下列有关说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 5.6LCO2气体中含有的氧原子数为0.5NA |
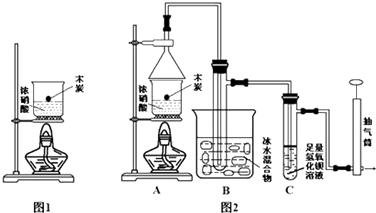

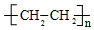 ;
;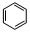 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$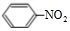 +H2O.
+H2O. ;
; .
.