题目内容
12.写出下列物质的电离方程式HCl=HCl=H++Cl-
Ba(OH)2=Ba(OH)2=Ba2++2OH-
Fe2(SO4)3=Fe2(SO4)3=2Fe3++3OH-.
分析 氯化氢为强电解质,完全电离;
氢氧化钡为强碱,为强电解质,完全电离;
硫酸铁为盐属于强电解质,完全电离;
解答 解:氯化氢为强电解质,完全电离,电离方程式:HCl=H++Cl-;
故答案为:HCl=H++Cl-;
氢氧化钡为强碱,为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
故答案为:Ba(OH)2=Ba2++2OH-;
硫酸铁为盐属于强电解质,完全电离,电离方程式:Fe2(SO4)3=2Fe3++3OH-;
故答案为:Fe2(SO4)3=2Fe3++3OH-;
点评 本题考查了离子方程式的书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循客观事实、遵循原子个数、电荷数守恒规律.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
2.下列仪器不能用酒精灯直接加热的是( )
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶 ⑥蒸发皿 ⑦容量瓶 ⑧表面皿.
| A. | ①③⑤⑦⑧ | B. | ①③④⑤⑦ | C. | ④⑦⑧ | D. | ②③⑤⑦⑧ |
3.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是( )
| A. | 分别取样配成溶液,分别往两份溶液中逐滴滴加几滴稀盐酸,一开始就有气体产生的为NaHCO3 | |
| B. | 分别取样加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,直接观察火焰的颜色 |
7.下列各组物质,按酸、碱、盐、氧化物顺序排列的是( )
| A. | H2S Mn(OH)2 MgCl2 H2O | |
| B. | HF KOH CO Na2CO3 | |
| C. | NH3 Al(OH)3 KBr MgO | |
| D. | H2O NaOH NH4Cl NH3﹒H2O |
17.下列电离方程式,书写正确的是( )
| A. | Al2(SO4)3=2Al3++3SO42- | B. | AlCl3=Al3++Cl3- | ||
| C. | NaHCO3=Na++H++CO32- | D. | KMnO4=K++Mn7++4O2- |
4.试回答下列各题:
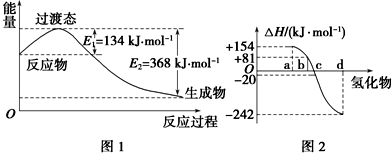
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.

(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.