题目内容
6.次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:(1)H3PO2是一元中强酸,写出其电离方程式H3PO2?H++H2PO2-.
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为+1.
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为H3PO4(填化学式).
③NaH2PO2为正盐(填“正盐”或“酸式盐”),其溶液显弱碱性(填“弱酸性”、“中性”或“弱碱性”).
分析 (1)H3PO2是一元中强酸,在水溶液里部分电离生成氢离子和酸根离子;
(2)①根据化合物中化合价的代数和为0确定P元素化合价;
②根据转移电子守恒判断氧化产物;
③H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性.
解答 解:(1)H3PO2是一元中强酸,在水溶液里部分电离生成氢离子和酸根离子,电离方程式为H3PO2?H++H2PO2-,
故答案为:H3PO2?H++H2PO2-;
(2)①根据化合物中化合价的代数和为0确定P元素化合价,O元素为-2价、H元素为+1价,所以P元素为+1价,故答案为:+1;
②该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1molH3PO2失去4mol电子,所以P元素为+5价,则氧化产物是H3PO4,故答案为:H3PO4;
③H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性,
故答案为:正盐;弱碱性.
点评 本题考查氧化还原反应、电离方程式的书写、盐类水解等知识点,明确物质的性质是解本题关键,利用守恒思想、电离方程式书写规则、盐类水解原理解答即可,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
14.在浓度均为4mol•L-1的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2:3,则加入铁粉的质量是( )
| A. | 11.2g | B. | 8.4g | C. | 16.8g | D. | 22.4g |
1.298.15K时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
15. 已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
 已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2N02 (红棕色)?N204 (无色)△H<0.将一定量的N02充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若不忽略体系温度变化,且没有能量损失,则 r(b)>r(c) | |
| D. | d 点:v(正)>v(逆) |
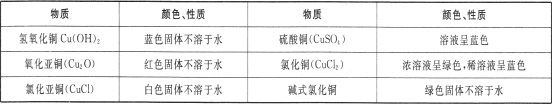
 涤、干燥,连接下列装置进行实验,验证阴极产物,
涤、干燥,连接下列装置进行实验,验证阴极产物,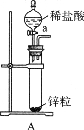
 .
.
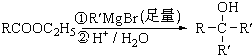
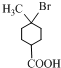 +2NaOH
+2NaOH
 +NaBr+2H2O.
+NaBr+2H2O.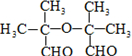 .
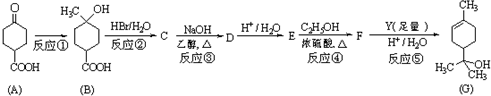
. 有机物A分子的结构简式为
有机物A分子的结构简式为 ;
; ;
; .
.