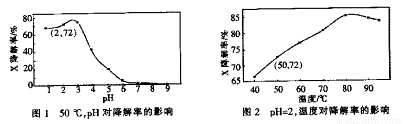
题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。则原溶液中的Na+的浓度(mol/L)为
A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
D
【解析】
试题分析:BaCl2和NaCl的混合溶液a L,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,消耗xmolH2SO4,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗ymolAgNO3,
则:SO42- + Ba2+═BaSO4↓ Ag+ + Cl-=AgCl↓
xmol xmol ymol ymol
c(Ba2+)=X/0.5a=2x/amol/L,c(Cl-)=y/0.5a=2y/amol/L,溶液呈电中性,设原溶液中的Na+浓度为b,由电荷守恒可知,(b+2x/a)×2=2y/amol/L,解得b=(2y-4x)/a mol/L,选D。
考点:考查化学计算。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6