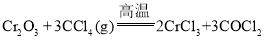题目内容
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
【答案】第二周期第ⅤA族 氯 ![]()
 Si
Si ![]() ①③ Si (s)+ 2Cl2(g)== SiCl4(l) △H = -687 kJ/mol NO 0.9mol NO2 1.3mol 2mol
①③ Si (s)+ 2Cl2(g)== SiCl4(l) △H = -687 kJ/mol NO 0.9mol NO2 1.3mol 2mol
【解析】
W、X、Y、Z、M、E、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与E的最低负化合价相同,则Z和E位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为Si元素,故Z为O元素,E为S元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素,据此分析。
W、X、Y、Z、M、E、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与E的最低负化合价相同,则Z和E位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为Si元素,故Z为O元素,E为S元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素。
(1)Y为N元素,在周期表中的位置为第二周期第ⅤA族,Q的元素名称为氯;
(2)X为C元素,其最高价氧化物CO2的电子式为![]() ;Y和W形成的五核离子NH4+的电子式为
;Y和W形成的五核离子NH4+的电子式为 ;
;
(3)元素周期表中同周期从左到右原子半径依次减小,同主族从上而下依次增大,表中元素原子半径最大的是Si;
(4)X与E的最高价氧化物的水化物H2SO4反应的化学反应式为![]() ;
;
(5) ① Y单质与H2S溶液反应,说明氧气的氧化性比硫强,从而说明O元素的非金属性比S元素的非金属性强,故正确;
②氧化性的强弱与得电子的多少无关,故错误;
③元素的非金属越强,简单气态氢化物的稳定性越强,故正确;
答案选①③;
(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,两种气体为NO、NO2,最终转化为NaNO3,1mol O2参与反应转移电子的物质的量为4mol,设NO、NO2的物质的量分别为xmol、ymol,根据Na、N守恒得x+y=2.2①,根据电子守恒得3x+y=4②,联立方程解得:x=0.9,y=1.3,根据电子守恒:n(CuSO4)=![]() =2mol,故答案为NO 0.9mol、NO2 1.3mol;2mol。
=2mol,故答案为NO 0.9mol、NO2 1.3mol;2mol。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体