题目内容
18.下列实验事实用元素周期规律解释不合理的是( )| 选顶 | 化学事实 | 周期律解释 |
| A | 向Na2SO3溶液中加稀盐酸产生气泡 | 非金属性:Cl>S |
| B | Mg、Al与同浓度的盐酸反应,Mg更剧烈 | 原子半径:Mg>Al |
| C | K与水的反应比Na与水的反应更剧烈 | 金属性:K>Na |
| D | 加热条件下HBr比HF更易分解 | 非金属性:F>Br |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl不是含氧酸,无法比较Cl、S的非金属性;
B.金属原子的原子半径越大,金属性越强,与酸反应越剧烈;
C.金属性越强,与水反应越剧烈;
D.非金属性越强,生成的氢化物越稳定.
解答 解:A.向Na2SO3溶液中加稀盐酸产生气泡,说明酸性HCl>H2SO3,由于HCl不是最高价含氧酸,无法比较S、Cl的非金属性,故A错误;
B.Mg、Al位于同一周期,原子半径Mg>Al,失去电子能力Mg>Al,即Mg的金属性较强,则Mg、Al与同浓度的盐酸反应,Mg更剧烈,故B正确;
C.金属性K>Na,则K与水的反应比Na与水的反应更剧烈,故C正确;
D.非金属性越强,对应氢化物越稳定,非金属性F>Br,则加热条件下HBr比HF更易分解,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.下列物质中,含有非极性键的离子化合物是( )
| A. | Na2O2 | B. | Na2O | C. | NaOH | D. | CaCl2 |
9. 常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
 常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )| A. | a 点所示的溶液中:c(H+ )=c(Cl-)+c(OH-) | |
| B. | b 点所示的溶液中:c(H+ )>c(Cl- )>c(HClO)>c(ClO- ) | |
| C. | c 点所示的溶液中:c(Na+ )=c(HClO)+c(ClO- ) | |
| D. | d 点所示的溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
6.互为同分异构体的一组物质是( )
| A. | 金刚石和石墨 | B. | ${\;}_1^1$H和${\;}_1^2$H | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH4和C2H6 |
13.萜品醇可作为消毒剂、抗氧化剂和溶剂,已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
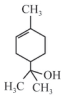

| A. | 1mol该物质最多能和1mol氢气发生加成反应 | |
| B. | 该物质不属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
3.下列关于化石燃料的加工说法正确的是( )
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
11.两种互为同位素的原子,不同的是( )
| A. | 核电荷数 | B. | 电子层结构 | C. | 核外电子数 | D. | 质量数 |
12.下列说法正确的是( )
| A. | 凡能起银镜反应的物质一定是醛 | |
| B. | 油脂、淀粉和蛋白质均属于高分子化合物 | |
| C. | 向经唾液充分作用后的苹果中滴入碘水鉴定淀粉是否水解完全 | |
| D. | 在加热和有催化剂的条件下,醇都能被空气中的O2所氧化,生成对应的醛 |
 甲醇是一种优质燃料,可制作燃料电池.
甲醇是一种优质燃料,可制作燃料电池.