题目内容
8.用已知浓度的NaOH溶液滴定未知浓度盐酸时,下列操作对实验结果没有影响的是( )| A. | 锥形瓶用蒸馏水洗涤后,直接盛盐酸溶液 | |
| B. | 中和滴定将要达到滴定终点时,眼睛注视滴定管中液面的位置变化 | |
| C. | 滴定管装碱液前未用标准碱液润洗 | |
| D. | 滴定时,锥形瓶摇动太剧烈,有少量溶液溅出 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液,待测液的物质的量不变,标准液的体积不变,结果不变,故A正确;
B.中和滴定实验中,左手调控滴定管的活塞,右手持锥形瓶,眼睛注视锥形瓶中颜色的变化判断滴定终点,故B错误;
C.碱式滴定管未用标准碱液润洗,碱液被稀释,若碱往酸中滴,造成消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)偏大,故C错误;
D.滴定时,锥形瓶摇动太剧烈,有少量溶液溅出,造成消耗的V(标准)偏小,c(待测)偏小,故D错误;
故选A.
点评 本题考查中和滴定中的误差分析,题目难度中等,明确中和滴定原理、仪器的使用、误差分析为解答的关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
18. 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率,提高苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品
B.甲醇用量多了
C.制备粗品时苯甲酸被蒸出.
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率,提高苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品
B.甲醇用量多了
C.制备粗品时苯甲酸被蒸出.
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下: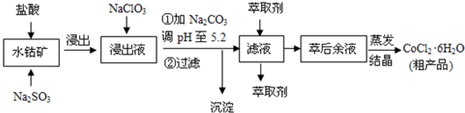
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
不慎向“浸出液”中加了过量NaClO3,可能会生成有毒气体.写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
不慎向“浸出液”中加了过量NaClO3,可能会生成有毒气体.写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
13.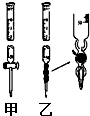 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
①滴定管如图所示,用甲(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸.
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
该未知盐酸的浓度为0.92mol•L-1(保留两位有效数字).
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变浅红色且30s不变色
(3)以下操作可能造成测定结果偏高的是BC
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
Ⅱ.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组同学设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol•L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
(1)含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式Fe3++3SCN-?Fe(SCN)3.
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果偏高(选填“偏高”“偏低”或“无影响”).
 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.①滴定管如图所示,用甲(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸.
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变浅红色且30s不变色
(3)以下操作可能造成测定结果偏高的是BC
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
Ⅱ.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组同学设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol•L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
(1)含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式Fe3++3SCN-?Fe(SCN)3.
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果偏高(选填“偏高”“偏低”或“无影响”).
20.用已知浓度的NaOH标准液滴定未知浓度的醋酸溶液,下列操作会导致测定结果偏高的是( )
| A. | 以甲基橙为指示剂滴至溶液由红色变橙色 | |
| B. | 滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失 | |
| C. | 滴定管读数时,滴定前仰视,终点时俯视 | |
| D. | 振荡时锥形瓶中的液滴溅出来 |
17.下列有关有机物的说法正确的是( )
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 2-甲基丁烷也称异丁烷 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
18.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要有于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
| A. | 导电性好 | B. | 不易生锈 | C. | 光泽度好 | D. | 强度高 |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下: