题目内容
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.如表是某温度下这四种酸在冰醋酸中的电离常数.从表格中判断以下说法中不正确的是( )
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中硫酸的电离方程式为H2SO4→2H++SO42- |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中这四种酸都没有完全电离 |
| D、电解质的强弱与所处的溶剂相关 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.硫酸在冰醋酸中存在电离平衡;
B.酸的电离平衡常数越大,该酸的酸性越强;
C.酸有电离平衡常数,说明酸中存在电离平衡;
D.这几种酸在水中都完全电离,在冰醋酸中都部分电离.
B.酸的电离平衡常数越大,该酸的酸性越强;
C.酸有电离平衡常数,说明酸中存在电离平衡;
D.这几种酸在水中都完全电离,在冰醋酸中都部分电离.
解答:
解:A.硫酸在冰醋酸中存在电离平衡,其电离方程式为H2SO4?H++HSO4-,故A错误;
B.酸的电离平衡常数越大,该酸的酸性越强,这几种酸中,电离平衡常数最大的是高氯酸,所以高氯酸的酸性最强,故B正确;
C.酸有电离平衡常数,说明酸中存在电离平衡,这几种酸在冰醋酸中都存在电离平衡,所以都没有完全电离,故C正确;
D.这几种酸在水中都完全电离,在冰醋酸中都部分电离,所以电解质的强弱与所处的溶剂相关,故D正确;
故选A.
B.酸的电离平衡常数越大,该酸的酸性越强,这几种酸中,电离平衡常数最大的是高氯酸,所以高氯酸的酸性最强,故B正确;
C.酸有电离平衡常数,说明酸中存在电离平衡,这几种酸在冰醋酸中都存在电离平衡,所以都没有完全电离,故C正确;
D.这几种酸在水中都完全电离,在冰醋酸中都部分电离,所以电解质的强弱与所处的溶剂相关,故D正确;
故选A.
点评:本题考查了电解质的电离,明确电离平衡常数与酸的强弱之间的关系,根据酸在水溶液里或冰醋酸中电离程度确定电解质强弱与溶剂的关系,注意:该溶液的溶剂是冰醋酸不是水.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图实验装置设计,能达到目的是( )
A、 验证乙酸、碳酸和苯酚的酸性强弱 |
B、 实验室制取乙酸丁酯 |
C、 测定乙醇结构式 |
D、 验证溴乙烷中的溴原子 |
下列表示对应化学反应的离子方程式正确的是( )
| A、Na2CO3溶液的水解:CO32-+H3O+?HCO3-+H2O |
| B、钢铁吸氧腐蚀时,负极反应式为:4OH--4e-═2H2O+O2↑ |
| C、向Al2(SO4)3溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀:2Al3++3SO42-+8OH-+3Ba2+═2AlO2-+3BaSO4↓+4H2O |
| D、氯化亚铁溶液中滴入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
将KClO3、I2各0.02mol加入12g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发).将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气.则A的化学式可能是( )
| A、I2Cl6 |
| B、HClO |
| C、IClO |
| D、KIO3 |
下列表述与示意图相符的是( )
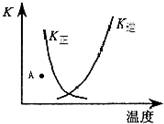

| A、正反应为吸热反应 | ||
| B、升高温度,有利于反应向正方向进行 | ||
| C、A点时,反应向逆反应方向移动 | ||
D、K正与K逆的关系是:K正=
|

 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: